Известно большое количество методов отведения мочи после радикальной цистэктомии по поводу рака мочевого пузыря, наиболее оптимальным из которых является формирование ортотопического кишечного резервуара с восстановлением естественного акта мочеиспускания.
Однако выполнение данной операции невозможно у больных с поражением мочеиспускательного канала. Для этой категории пациентов предложена операция формирования гетеротопического континентного резервуара. Методика формирования резервуара Кокка (N.G.Коck), предложенная в 1972 г, является наиболее известной операцией подобного типа Используется сегмент подвздошной кишки длиной 60—65 см, который условно делится на 4 участка: проксимальный участок 12 см для формирования клапана и стомы, два средних сегмента по 20—22 см, образующих U-образный резервуар, и дистальный участок для уретероилеоанастомоза (рис.1). Оба колена U-образного резервуара рассекают по противобрыжеечному краю и медиальные края разрезов сшивают между собой непрерывным швом нитью Vicryl 3/0. Вдоль проксимального конца рассекают брыжейку (демезентеризация) в 2 см от резервуара, длина разреза — 7 см. Формируют изоперистальтический инвагинат-клапан. С помощью сшивающего аппарата клапан фиксируют к задней стенке резервуара, после чего укрепляют отдельными серозомышечными швами с помощью специальной синтетической сетки и дополнительно прошивают аппаратом на 10 и 14 часах (рис. 2). Аналогичный клапан может быть сформирован в дистальном конце в области уретероилеоанастомоза, чаще всего это необходимо при выраженных уретерогидронефрозах. При выполнении уретероилеоанастомоза с дистальным концом сегмента используется методика Le Duc. Далее формируется стома в области пупка с проксимальным клапаном (рис.3). Данная методика позволяет избежать постоянного истечения мочи на кожу. Для эвакуации мочи из резервуара используется периодическая катетеризация каждые 4 ч.
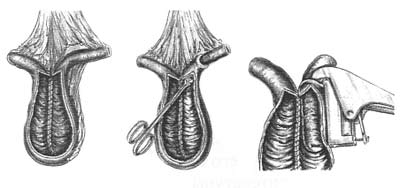
Рис.1. Формирование резервуара и клапана по N.G.Коck
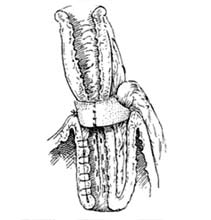
Рис.2. Клапан в поперечном разрезе
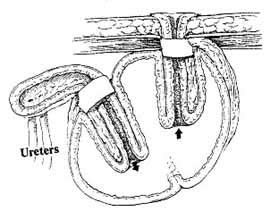
Рис.3. Окончательный вид резервуара
Недостатками этой операции являются необходимость рассечения брыжейки на протяжении 7 см, использование синтетического материала и сшивающих аппаратов при формировании клапана, что может ухудшать питание кишки с последующим нарушением удерживающего механизма. Для формирования одного клапана используется сшивающий аппарат с тремя кассетами. Миграция металлических скрепок в просвет резервуара может приводить к образованию конкрементов, этому может способствовать и U-образная форма резервуара. С целью уменьшения количества осложнений в отдаленном послеоперационном периоде и устранения необходимости использования сшивающих аппаратов и синтетического материала при формировании клапана в НИИ онкологии и медицинской радиологии им. Н.Н.Александрова в 2002 г. была разработана оригинальная методика формирования континентного гетеротопического резервуара.
Техника операции
Хирургический доступ: срединная лапаротомия с окаймлением пупочного кольца, отступя от последнего 3 см (рис. 4). На первом этапе проводится радикальная цистэктомия с тазовой лимфодиссекцией, при поражении мочеиспускательного канала — уретрэктомия. Для формирования резервуара используется изолированный сегмент подвздошной кишки 60—65 см (рис.5). Во избежании последующих серьезных нарушений пищеварения и обмена веществ сохраняется терминальный отдел тонкой кишки (20—25 см). Отступя 20—25 см от илеоцекального угла рассекается брыжейка тонкой кишки на протяжении 10—15 см с сохранением A. Ileocolica. Проксимальный разрез брыжейки — более короткий (5—8 см), чтобы оставить интактными минимум 2 сосудистые аркады, питающие изолированный сегмент кишки. С целью облегчения обнаружения кишечных сосудов используется проходящий боковой свет.
Рис.4. Операционный доступ
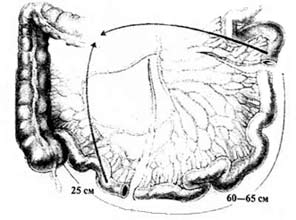
Рис.5. Резекция кишки
По линии разрезов брыжейки между мягкими кишечными жомами или с использованием сшивающих аппаратов рассекается тонкая кишка. Непрерывность кишечника восстанавливается наложением тонко-тонкокишечного анастомоза по типу "конец в конец", для чего используется одно- или двухрядный шов нитями Vicryl или Polysorb 3/0 или 4/0, может применяться также аппаратный шов. Отверстие в брыжейке ушивается с обеих сторон. Изолированный участок тонкой кишки отмывается от содержимого, после чего выполняется операция формирования резервуара.
Формирование резервуара
Изолированный сегмент кишки на брыжейке рассекается вдоль по противобрыжеечному краю (рис. 6), концевые отрезки (по 10 см длиной) оставляют неизмененными. Рассеченный сегмент кишки укладывается в виде буквы W, прилежащие края разрезов сшивают между собой непрерывными обвивными швами с перехлестом нитью Vicryl или Polysorb 3/0. Затем ушивают переднюю стенку резервуара. Мочеточники анастомозируются с дистальным концом изолированной кишки, проксимальный конец используется для формирования клапана и стомы.
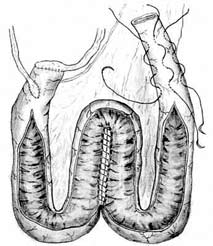
Рис.6. Формирование W-образного резервуара и клапана
Левый мочеточник проводится на правую сторону забрюшинно ниже места отхождения A. mesenterica inferior перед аортой и нижней полой веной. Концевые отрезки мочеточников рассекаются вдоль на протяжении 1,5 см. В дистальном конце тонкокишечного сегмента по противобрыжеечному краю парамедиально производится продольный разрез для правого мочеточника длиной 1,5 см (рис. 7). Края рассеченного правого мочеточника сшиваются с краями продольного разреза путем наложения непрерывного серозомышечного шва нитью Vicryl 4/0, при этом шов начинается от проксимального конца анастомоза, где захватывается только незначительное количество ткани для предотвращения сужения просвета мочеточника. Анастомоз между левым мочеточником и дистальным концом изолированного сегмента кишки накладывается по типу "конец в конец". Мочеточниковые катетеры вводятся до лоханок, фиксируются быстро рассасывающейся нитью и проводятся через тубулярный сегмент кишки по направлению к кишечному резервуару, а затем выводятся наружу через проксимальный отрезок кишки и стому.
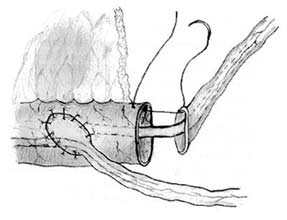
Рис.7. Мочеточниковый анастомоз
Для формирования клапана в проксимальном отрезке кишки накладывается 6 одиночных серозомышечных швов путем трех последовательных проколов стенки кишки с интервалом 1 см (см. рис. 6). После завязывания нитей образуется губовидный клапан (рис. 8). При достаточной длине проксимального участка кишки может быть сформировано последовательно два клапана с целью обеспечения большей надежности удерживающего механизма.
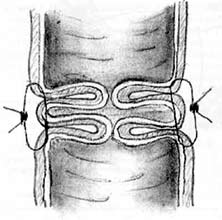
Рис.8. Губовидный клапан (поперечный разрез)
Далее формируется стома в области пупка со сформированным клапаном (рис. 9). Мочеточниковые катетеры, выведенные через стому, фиксируются к коже. После дренирования брюшной полости и полости малого таза рану ушивают. Через стому в резервуар устанавливается дренаж, который промывается с эвакуацией всего содержимого каждые 4 ч на протяжении 5 дней после операции. Мочеточниковые катетеры удаляются на 13—14-е сутки. На 20-й день из резервуара удаляется постоянный дренаж и резервуар катетеризируется с промыванием каждые 2 ч днем и каждые 3 ч ночью в течение 2—3 сут, а затем каждые 4 ч.
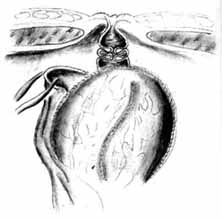
Рис.9. Окончательный вид резервуара
Предложенный метод операции иллюстрируется следующим наблюдением
Больной Д., 32 лет, находился на лечении в онкоурологическом отделении НИИО и МР с 18.05.2002 г. Обратился с жалобами на умеренную примесь крови в моче, частое и болезненное мочеиспускание. При обследовании установлен диагноз: рак мочевого пузыря Т4аmN0M0G3. Стадия III. При УЗИ, рентгенологическом и эндоскопическом исследовании выявлено, что весь мочевой пузырь поражен опухолями до 6 см в диаметре, врастающими в предстательную железу и поражающими уретру. 4.06 произведена операция: диагностическая трансуретральная резекция (ТУР) мочевого пузыря, при которой удалена основная масса опухолей из-за невозможности их радикального удаления. Гистологическое заключение от 12.06: низкодифференцированный переходно-клеточный рак с инвазией мышечного слоя.Больному проведено два курса полихимиотерапии (ПХТ) по схеме M-VAC (метотрексат, адриамицин, винбластин, цисплатина). На фоне ПХТ отмечено дальнейшее прогрессирование опухоли.
15.10 проведена операция: радикальная цистэктомия, резекция уретры с формированием континентного гетеротопического резервуара по описанной выше методике, гастростомия. Гистологическое заключение от 21.10: высокодифференцированный переходно-клеточный рак, врастающий в мышечный слой стенки мочевого пузыря. Послеоперационный период протекал без осложнений. Гастростома удалена на 10-е сутки, мочеточниковые катетеры на — 13-й и 14-й дни. На 21-й день выполнены резервуарограмма и внутривенная урография — выхода контрастного вещества за пределы мочевых путей нет; на урограмме — выраженная положительная динамика со стороны верхних мочевых путей (рис. 10, а,б). Катетер из резервуара удален. При катетеризации резервуара катетер свободно проходит через клапан, промежуток между катетеризациями — 3 ч. Больной наблюдается 28 мес: метастазов и рецидивов опухоли не выявлено, удерживающая функция резервуара и качество жизни удовлетворительные.
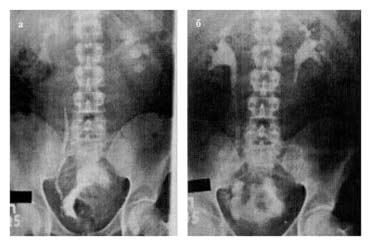
Рис.10. Экскреторная урограмма, выполненная у больного Д., 32 года, до (а) и через 3 недели после (б) операции
По описанной выше методике выполнено 3 операции. Все пациенты — мужчины 32, 54 и 65 лет. У всех больных отмечено субтотальное поражение мочевого пузыря низкодифференцированными инвазивными опухолями с распространением на простату и мочеиспускательный канал (Т4аmN0M0G3, стадия III), по поводу чего выполнялись радикальная цистэктомия, уретрэктомия с формированием континентного гетеротопического резервуара. Продолжительность операции — 4,5—5,5 ч. Осложнений в ходе операции и в ближайшем послеоперационном периоде не отмечено. Больные наблюдаются от 24 до 28 мес: метастазов и рецидивов опухоли нет, удерживающая функция резервуара и качество жизни удовлетворительные, поздних осложнений не отмечено.
По нашему мнению, использование предлагаемой методики позволяет уменьшить количество осложнений в отдаленном послеоперационном периоде за счет шаровидной формы резервуара, оригинальной методики формирования удерживающего клапана и мочеточникового анастомоза, а также устранить необходимость использования сшивающих аппаратов и синтетического материала при формировании клапана. Разработано большое количество методов деривации мочи для обеспечения удовлетворительного качества жизни после удаления мочевого пузыря. Кондуит из подвздошной кишки был впервые предложен Е.М.Bricker в 1950 г., и этот метод оставался предпочтительным длительное время.
Начиная с 50-х годов прошлого века, реконструктивная хирургия нижних мочевых путей после цистэктомии развивалась по трем направлениям: неконтинентная кожная форма отведения мочи (кондуит из подвздошной или толстой кишки); континентная кожная форма отведения мочи (резервуар для мочи вне малого таза с выведением мочи на кожу передней брюшной стенки с использованием механизма, препятствующего самопроизвольному истечению мочи — континентный гетеротопический резервуар); и, наконец, ортотопическая форма отведения мочи (резервуар для мочи создается в тазу и анастомозируется с уретрой — искусственный мочевой пузырь).
В течение последнего десятилетия операция Брикера стала менее популярной, сегодня чаще используют ортотопическую реконструкцию мочевого пузыря, которая прошла путь от экспериментальной процедуры до стандартной операции в крупных медицинских центрах и стала предпочтительным методом отведения мочи как у мужчин, так и у женщин. Использование подвздошной кишки для замещения мочевого пузыря получило всеобщее признание. Совершенствование хирургической техники привело к тому, что даже у пациентов со значительной сопутствующей патологией вполне осуществима радикальная цистэктомия с илеоцистопластикой . В настоящее время стало важным выбрать именно тот метод, который обеспечит достаточную радикальность операции, позволит выполнить ее с наименьшим числом как ближайших, так и отдаленных осложнений и обеспечит наилучшее качество жизни больного после операции.
Возможное влияние ортотопического отведения мочи на качество выполнения цистэктомии и скорректированную выживаемость изучалось О.Yossepowitch и соавт. Не получено статистических различий в выживаемости больных с кишечным "мочевым пузырем" и подвздошным кондуитом. Частота местных рецидивов составила 11%, рецидивы в уретре выявлены только у 2% больных с кишечными резервуарами. Сделан вывод, что создание ортотопического резервуара для мочи не ухудшает качество цистэктомии и не затрудняет лечение местных рецидивов и отдаленных метастазов в случае их возникновения.
При исследовании больных, умерших от рака мочевого пузыря, обнаружено, что рак in situ в мужской уретре встречается в 18—19% случаев. Большое число наблюдений показало, что рецидивы в уретре после цистэктомии возникают у 8—12% больных в сроки от 1 до 9 лет после цистэктомии.
Ряд авторов рекомендуют проводить всем больным профилактическую уретрэктомию одновременно с цистэктомией, однако в большинстве случаев это нерационально. Показания к одномоментной цистуретрэктомии: распространение опухоли на простатическую часть мочеиспускательного канала, очевидная синхронная опухоль уретры. Пациенты, которым выполнена уретрэктомия, являются кандидатами на формирование континентного гетеротопического резервуара.
Во всех остальных случаях, особенно при наличии мультифокального рака in situ, рекомендуются регулярное цитологическое исследование смывов из мочеиспускательного канала каждые 6—12 мес. Положительный результат цитологического исследования определяет прямое показание к отсроченной уретрэктомии. При соблюдении соответствующих показаний рецидивы в уретре после илеоцистопластики развиваются достаточно редко — менее чем в 5% случаев. Риск рецидива в уретре имеют больные с множественными опухолями мочевого пузыря, сопутствующей карциномой in situ а также с распространением опухоли на простатическую уретру и особенно в строму предстательной железы. Ранее рост опухоли в простатической уретре служил абсолютным противопоказанием для использования последней для отведения мочи.
Однако в ряде исследований было показано, что только инвазия опухоли в протоки или паренхиму предстательной железы связана с развитием рецидива в оставшейся уретре. Это упростило решение вопроса о возможности выполнения илеоцистопластики у того или иного больного. Интраоперационное экспресс-гистологическое исследование края отсечения уретры с апикальной частью простаты оказалось вполне достаточным для формирования показаний к уретрэктомии и выбора метода отведения мочи.
Мы придерживаемся подобной тактики с выполнением интраоперационного экспресс-гистологического исследования. Из 100 операций ортотопической реконструкции, проведенных в нашем отделении в 1999—2004 гг., рецидив в уретре через 11 мес после илеоцистопластики выявлен у 1 больного, которому выполнена эндоскопическая операция с последующей внутрипросветной брахитерапией. Больной наблюдается 2 года без рецидива и отдаленных метастазов. В связи с этим сегодня крайне важно разработать такой универсальный способ кишечной пластики, который позволял бы в ходе операции в зависимости от данных интраоперационного экспресс-гистологического исследования легко переходить от ортотопического отведения мочи к гетеротопическому. Предложенный способ формирования континентного гетеротопического резервуара вполне отвечает этому требованию. Он удачно сочетается с модифицированной илеоцистопластикой по R. Hautmann (рис. 11).
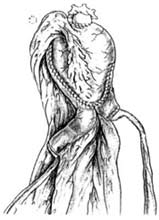
Рис.11. Модифицированная илеоцистопластика по R.Hautmann
Переход от одного вида операции к другому может понадобиться и при возникновении проблем с наложением анастомоза между уретрой и уже сформированным резервуаром (например, выраженное натяжение вследствие короткой брыжейки тонкой кишки). Возможность возникновения подобных ситуаций следует учитывать, а использование взаимозаменяемых методик позволяет избежать затруднений в ходе операции и серьезных осложнений.
Еще один важный вопрос — регионарное метастазирование. Несмотря на рутинное выполнение тазовой лимфаденэктомии при радикальной цистэктомии, обоснованность выполнения илеоцистопластики при наличии метастазов в тазовые лимфатические узлы остается предметом споров. C одной стороны, в недавних исследованиях показано терапевтическое значение тщательной тазовой лимфодиссекции при раке мочевого пузыря. Продемонстрировано увеличение выживаемости при тщательном удалении лимфатических узлов. Такой подход привел к повышению 5-летней скорректированной выживаемости до 46% у пациентов с регионарными метастазами. Частота местных рецидивов после радикальной цистэктомии по поводу инвазивного рака мочевого пузыря достигает 11—12%, однако, как оказалось, только половина этих больных испытывает проблемы с ортотопическим резервуаром в течение последних 6 мес жизни. Продолжительность жизни после развития местного рецидива весьма мала, но большинство пациентов могут рассчитывать на нормальную функцию кишечного "мочевого пузыря". Что касается формирования гетеротопического резервуара у больных с регионарными и даже отдаленными метастазами, то, по нашему мнению, наличие метастазов не влияет на функцию резервуара и не должно служить ограничением для выполнения данной операции. Единственной особенностью лечения у этих больных является необходимость установки постоянного катетера в резервуар на все время проведения химиотерапии для исключения обратного всасывания препаратов, что в свою очередь может привести к передозировке и значительному увеличению токсичности.
Таким образом, новую операцию формирования гетеротопического континентного резервуара можно рекомендовать для отведения мочи после цистэктомии у пациентов, которым противопоказано ортотопическая реконструкция мочевого пузыря.
Авторы: С.А.Красный, О.Г.Суконко, С.Л.Поляков
ГУ НИИ онкологии и медицинской радиологии им. Н.Н.Александрова, Минск, Белорусь
Материал взят из журнала "Онкоурология", №1, 2005.



