Мутации андрогенных рецепторов (АР), которые влияют на специфичность действия на них стероидных гормонов, выявлены в ряде случаев андроген?независимого рака предстательной железы. Чтобы выяснить, какие функциональные характеристики таких мутантных АР влияют на их отбор in vivo, проведена оценка действия на эти рецепторы ряда стероидных гормонов и антиандрогенов. Клетки CV?1 котрансфицировали АР дикого типа или мутантными АР и плазмидой, содержащей регулятор люциферазы, регулируемый структурами, реагирующими на андрогены.Для 5a?дигидротестостерона, самого активного андрогена в нормальной предстательной железе, и андростендиона, главного андрогена, продуцируемого в надпочечниках, составлены и проанализированы кривые доза — ответ. Хотя мутантные АР реагировали на оба стероида, ответ был таким же или менее выраженным, чем в случае АР дикого типа. Наоборот, ответ на флутамид, антагонист АР дикого типа конкурирующего действия, значительно увеличивался при наличии мутаций.Такие же ответы наблюдались и в случае второго антиандрогена — нилутамида.
Бикалутамид — еще один антиандроген, схожий с флутамидом, — проявил себя как антагонист мутантных АР. Наконец, согласно наблюдениям, флутамид оказался частичным слабым агонистом АР дикого типа в этой системе. Эти результаты указывают, что флутамид в комбинации с кастрацией (медикаментозной или хирургической) при раке предстательной железы может избирательно действовать на опухолевые клетки — носители АР, индуцируемых флутамидом.
Рак предстательной железы — самая распространенная злокачественная опухоль у мужчин, и АРиграют важную роль в ее развитии. Большая доля случаев рака предстательной железы относится к андроген?зависимому типу, и при этой форме заболевания единственный эффективный метод лечения — снижение уровней андрогенов (кастрация). Хотя большинство опухолей вначале реагирует на кастрацию, через 2—3 года их большая доля рецидивирует. Рецидивы рака предстательной железы, возникшие после кастрации, названы гормонально?независмыми или АН, но у меньшинства больных гормонотерапия второй линии остается эффективной.Препараты для гормонотерапии второй линии либо угнетают синтез андрогенов надпочечников, либо блокируют АР непосредственно по действием антиандрогена, что указывает на гетерогенность АН?рака предстательной железы и на вероятность того, что у них в некоторой степени сохраняется гормональная зависимость.АР экспрессируются на нормальных или повышенных уровнях в большинстве случаев АН?рака предстательной железы. Однако остается неясным, в какой степени такие АР участвуют в стимуляции опухолевых клеток после кастрации. Недавно при АН?раке предстательной железы был идентифицирован ряд АР с мутациями в домене, связывающем гормон. В некоторых случаях показано, что эти мутации изменяют ответ на эстроген, прогестерон и/или андрогены надпочечников. Однако до сих пор не ясно, как такие функциональные изменения влияют на отбор этих опухолевых клеток in vivo.
Эффективность кастрации может увеличить с помощью антиандрогенов, которые прямо связываются с АР и блокируют действие остаточных андрогенов. Такой вид лечения называют полной андрогенной блокадой, и в большинстве случаев для этой цели применяли флутамид. Любопытно, что до 40% больных, у которых заболевание начало прогрессировать в результате полной андрогенной блокады, демонстрируют второй ответ на отмену флутамида (синдром отмены флутамида). Это наблюдение указывает, что флутамид прямо или опосредованно стимулирует пролиферацию клеток рака предстательной железы у некоторых категорий больных.Один из возможных механизмов прямой стимуляции роста рака предстательной железы под действием флутамида — активация мутантных АР. Выделена клеточная линия LNCaP, содержащая мутантный АР, который активируется флутамидом. Кроме того, аналогичные мутации идентифицированы у нескольких больных с АН?раком предстательной железы.Чтобы провести дальнейшую оценку значения мутаций АР, выявленных у больных с АН?раком предстательной железы, в этом исследовании изучены ответы этих АР на стероидные гормоны и антиандрогены.
Полученные результаты указывают, что эти мутации не усиливают ответ АР на дигидротестостерон — самый активный андроген в нормальной предстательной железе — в малых концентрациях. Ответ на андростендион — андроген, в основном продуцируемый в надпочечниках, не изменялся, независимо от наличия или отсутствия мутаций. Наоборот, отмечено значительное усиление активации АР под действием флутамида. Эти результаты указывают, что мутации АР могут отбираться in vivo флутамидом, что объясняет развитие синдрома отмены флутамида. Обсуждается тактика лечения, которая может свести к минимуму отбор таких мутаций.
Материалы и методы
Плазмиды, регулирующие экспрессию АР. Вектор экспрессии, основанный на SV40 и содержащий АР дикого типа человека, pARO, был любезно предоставлен доктором Альбертом Бринкманом (Университет Эразама, Роттердам, Нидерланды). Сайты рестрикции в АР были использованы для замены фрагментов АР дикого типа на соответствующие фрагменты, содержащие точковые мутации. Эти встроенные фрагменты, содержащие точковые мутации, были секвенированы, чтобы полностью исключить мутации в других сайтах. Образцы, взятые у больных, описаны ранее. Эти включали мутации в кодоне 902 (Гли на Арг, Q902R), кодоне 877 (Тре на Сер, T877S), кодоне 874 (Гис на Тир, H874Y) и кодоне 721 (Ала на Тре, А721Т).Кроме того, анализировали мутации, описанные ранее в этом исследовании, в кодонах 877 (Тре на Ала, Т877А) и 715 (Вал на Мет, V715M). Мутантный АР Т877А экспрессировался в клеточной линии LNCaP и был выделен путем ПЦР?амплификации из этой клеточной линии. Мутацию V715M выделили независимо у больного с АН?раком предстательной железы, причем она оказалась идентичной мутации V715, описанной ранее. Плазмида MMTVp3LUC, производное pHHLUC, — регулятор люциферазы — использованная в этих исследованиях, регулировалась структурами, реагирующими на андрогены в длинных концевых повторах вируса опузоли молочной железы мыши (любезно предоставлена доктором Ричардом Пестеллом, Медицинский факультет Ноствестернского университета, Чикаго, Иллинойс).Трансфекции. Клетки CV?1, культивируемые в DMEM с 5% FCS на 24?луночных плашках, котрансфицировали АР, MMTVpA3LUC, и pSV?b-галактозидазной (Prjmega Cjrp., Мэдисон, Висконсин) плазмидами, применяя фосфат кальция (Набор для трансфекции клеток млекопитающих; Speciality Media, Lavalette, Нью?Джерси), как рекомендуется изготовителем. Каждая лунка с клетками CV?1 содержала 460 мкл DMDM с 5% FCS, и в нее вносили 40 мкл из 1 мл смеси, содержащей 5 мкг АР, 10 мкг LUC и 5 мкг b?галактозидазы. Примерно через 16 часов после трансфекции клетки отмывали, и в каждую лунку на 4 часа добавляли по 450 мкл DMEM, содержащего 5% пропущенной через активированный уголь FCS (не содержащей гормонов) (Hyclone Laboratories, Логан, Юта). Специфические гормоны добавляли в 50 мкл, а затем клетки инкубировали в течение еще 24 часов. Затем клетки лизировали, и измеряли активность люциферазы и b?галактозидазы. Контроль включал нетрансфицированные и трансфицированные клетки без добавления гормона.
Исследуемые стероидные гормоны включали дигидротестостерон, андростендион, прогестерон и эстрадиол (Steraloid. Inc., Уилтон, NH). Исследуемые антиандрогены включали гидроксифлутамид (активный метаболит флутамида, подарок от Shering—Plough, Кенилуорт, Нью?Джерси), нилутамид (Roussel—Uclef Company, Романвиль, Франция) и бикалутамид (ICI 176,334, Касодекс; Зенека Фармасьютиклз). Исходные уровни определяли в экстрактах псевдотрансфицированных клеток; активность люциферазы делили на 10, чтобы достичь RLU. Все измерения производили четырежды в каждом отдельном эксперименте. Ниже представлены результаты репрезентативных экспериментов.
Результаты
Стимуляция АР дикого типа и мутантных АР андрогенами. Клетки СМ?1 котрансфицировали плазмидами, экспрессирующими АР дикого типа или мутантные АР, и плазмидой?регулятором люциферазы, а затем после инкубации с различными количествами дигидротестостерона измеряли активность люциферазы. Минимальная активность люциферазы наблюдалась у АР дикого типа и мутантных АР в отсутствие гормонов (рисунок 1). В ряде экспериментов по трансфекции АР дикого типа реагировали на дигидротестостерон в концентрациях менее 0,1 нМ гормона, а максимальный ответ зарегистрирован при концентрациях ДГТ между 1 и 10 нМ (рисунок 1). Уменьшение активности наблюдалось при более высоких концентрациях ДГТ (100 нМ), но этот факт вряд ли имеет физиологическое значение.
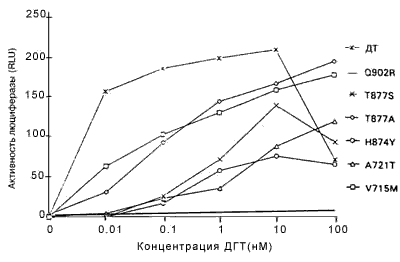
Рисунок 1. Стимуляция мутантных AP и AP дикого типа под действием ДГТ
AP дикого типа (ДТ) и мутантные AP преходящим образом экспрессировали в клетках CV-I, содержащих ген-регулятор люциферазы, затем их инкубировали в присутствии различных концентраций ДГТ. Активность люциферазы, выраженная в RLUs приводили к активности b-галактозидазы, и делили на 103, чтобы соответствовать стандартным RLUs. Все измерения проводили четырежды; показаны результаты репрезентативных экспериментов. SE была менее 25% среднего, за исключением V715M при концентрации 0,01 нМ, которая составляла 29% в этом случае.
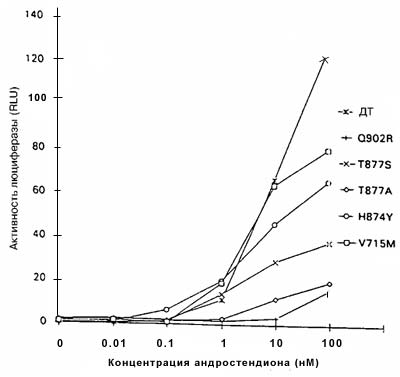
Рисунок 2. Стимуляция AP дикого типа и мутантных AP под действием андростендиона
AP дикого типа (ДТ) и мутантные AP преходящим образом экспрессировали в клетках CV-1, содержащих ген-регулятор люциферазы, затем их инкубировали в присутствии различных концентраций андростендиона. Все измерения проводили четырежды; показаны результаты репрезентативных экспериментов. SE была менее 25% среднего, за исключением Q902R при концентрации 100 нМ и Т877S при концентрациях 1 нМ / 0,1 нМ / 0,01 нМ, которые составляли 27% соответственно.
Каждый мутантный АР, исследуемый в этих экспериментах, за исключением мутанта Q902R, заметно реагировал на ДГТ (рисунок 1). Однако увеличения ответа на ДГТ со стороны мутантных АР по сравнению с АР дикого типа, за исключением наибольшей концентрации ДГТ (100нМ), не отмечено. Более того, концентрация ДГТ, необходимая для достижения половины максимальной активности, составляла менее 0,01 нМ для АР дикого типа и минимум в десять раз больше для мутантных АР (рисунок 1). Следовательно, эти результаты указывают, что опухолевые клетки, экспрессирующие мутантные АР, не отбирались на основании их реакции на низкие концентрации ДГТ.Важный источник андрогенов в предстательной железе после кастрации — надпочечники, и ранее сообщалось, что мутантный АР V715M усиленно реагировал на андростендион - главный андроген, продуцируемый в надпочечниках. По этой причине оценивали ответы мутантных АР на андростендион. При наибольшей концентрации андростендиона (100 нМ) активность АР дикого типа была больше, чем активность мутантных АР (рисунок 2). При низких концентрациях андростендиона активность мутантных АР V715M, H874Y и T877S была сравнимой с активностью АР дикого типа, но не превышала ее. Активность мутантных АР T877A, Q902R и А721Т оказалась ниже, чем у АР дикого типа при всех концентрациях андростендиона (рисунок 2, некоторые данные не представлены).Ответ на эстрадиол и прогестерон со стороны мутантных АР. Ответ нескольких мутантных АР на эстрадиол и/или прогестерон изучен ранее. Показано, что мутантные АР T877A, T877S и H874Y усиленно реагировали на эстрадиол и прогестерон по сравнению с АР дикого типа, в то время, как мутантный АР V715M усиленно реагировал на прогестерон. Мутантные АР А721Т и Q902R ранее не изучали, поэтому мы их исследовали. На рисунке 3 показано, что ни один из этих мутантных АР усиленно не реагировал на прогестерон и эстрадиол по сравнению с АР дикого типа.Ответ на антиандрогены. Умеренный, но воспроизводимый ответ АР дикого типа отмечался при высоких концентрациях гидроксифлутамида (рисунок 4А). Такой же слабый ответ отмечался на нилутамид и гидроксифлутамид отмечался со стороны мутантного АР А721Т (рисунок 4А). Гидроксифлутамид стимулировал мутантный АР V715M в большей степени, хотя этот ответ примерно в 20 раз был меньше того, который вызвал ДГТ при действии на АР дикого типа. Более того, он наблюдался только при наибольших концентрациях гидроксифлутамида.
Стимуляция мутантных АР H874Y и T877S под действием гидроксифлутамида была более заметной (рисунок 4Б). Активация этих АР отчетливо наблюдалась при концентрации гидроксифлцтамида 100 нМ, а максимальный ответ оказался только в 4 раза меньше, чем ответ на ДГТ. Мутантные АР H874Y и T877S также активировались под действием нилутамида. Наоборот, ни мутантные АР, ни АР дикого типа не реагировали на бикалутамид (рисунок 4Б).Затем измеряли способность бикалутамида ингибировать мутантные АР T877S и H874Y. На рисунке 5 показано, что бикалутамид сохраняет способность нейтрализовать ответ на андрогены (ДГТ и андростендион), а также эстрадиол и прогестерон, со стороны мутантных АР.
Обсуждение
Это исследование было направлено на изучение гипотезы о том, что ответ на некоторые гормоны и препараты может играть роль в стимуляции роста in vivo АН?рака предстательной железы, экспрессирующего определенные мутантные АР. В отсутствие гормона никакой активности не отмечено, что доказывает, что ни один мутантный АР не обладает конституциональной активностью. Хотя все мутантные АР, за исключением Q902R, реагировали на ДГТ, усиления ответа на этот гормон по сравнению с АР дикого типа не наблюдалось. Особенно важен тот факт, что ответ АР дикого типа был заметно более выраженным при низких концентрациях ДГТ. Следовательно, хотя мутантные АР способны реагировать на ДГТ, эти результаты не поддерживают гипотезу о том, что опухолевые клетки, экспрессирующие такие мутантные АР, усиленно реагируют на низкие концентрации ДГТ in vivo после кастрации.Ответы на андростендион также наблюдались стороны всех АР, включая слабый ответ Q902R. В отличие ответа на ДГТ, несколько мутантных АР реагировали примерно также, как АР дикого типа при концентрациях андростендиона в пределах 1 нМ. Хотя in vivo могут играть роль даже малейшие различий в ответе на андростендион, эти эксперименте предполагают, что в отборе этих мутаций усиленный ответ мутантных АР не участвует. Следует отметить, что в опубликованной ранее статье указано, что ответ мутантного АР V715M на андростендион примерно в 4 раз превышал ответ АР дикого типа при концентрации гормона от 10 до 50 нМ. Однако в следующем сообщении того же автора такого же значимого различия не отмечено, что согласуется результатами нашей работы.
Три из мутантных АР (V715M, H874Y и T877S) активировались под действием гидроксифлутамида и нилутамида. Наоборот, эти мутации не влияли на ответ на бикалутамид, который оставался эффективным антиандрогеном. Мутантный АР из клеточной линии LNCaP (T877A) также активировался под действием гидроксифлутамида и ингибировался бикалутамидом. Активация АР V715M гидроксифлутамидом в ранее проведенном исследовании не наблюдалась, но в более поздней работе те же авторы пришли к заключению, что этот АР стимулируется под действием высоких концентраций гидроксифлутамида.
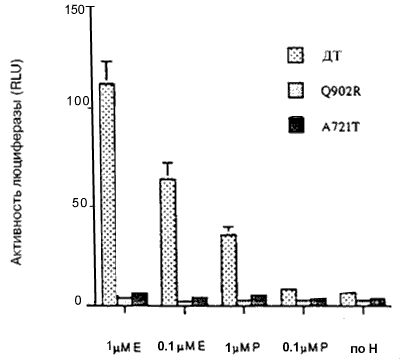
Рисунок 3. Ответ мутантных AP на эстрадиол и прогестерон
AP дикого типа (ДТ) и мутантные AP преходящим образом экспрессировали в клетках CV-1, содержащих ген-регулятор люциферазы, затем их инкубировали в присутствии различных концентраций эстрадиола (Е) и прогестерона (П). Все измерения проводили четырежды; показаны результаты репрезентативных экспериментов с ошибкой среднего: максимальный ответ на 0,1 мкМ ДГТ; для АР ДТ в этом эксперименте составил 341.
Наконец, следует отметить, что АР, которые заметно активируются под действием гидроксифлутамида, а именно: T877S и H874Y, - выделены у больных, которых ранее лечили флутамидом. Мутантный АР V715R также выделен у больного, который ранее получал флутамид.Ясно, что система функциональной оценки, использованная в нашей работе, имеет свои недостатки и не может полностью предсказать поведение таких мутантных АР in vivo в клетках рака предстательной железы по ряду причин. Мутации АР могут нарушать взаимодействие с некоторыми белками коактиваторами, специфичными для предстательной железы и связанными с АР. АР, возможно, выполняют дополнительные функции в клетках предстательной железы, не отраженные в этих экспериментах. Внутриклеточные концентрации ДГТ и других гормонов в клетках рака предстательной железы также остаются неизвестными. Тем не менее, эта система количественного анализа указывает, что несколько мутаций АР изменяют свойства АР таким образом, что это может приводить к положительному отбору соответствующих опухолевых клеток во время лечения флутамидом.Такие мутации АР могут объяснить случаи неудачного исхода лечения флутамидом и причины развития синдрома отмены флутамида.
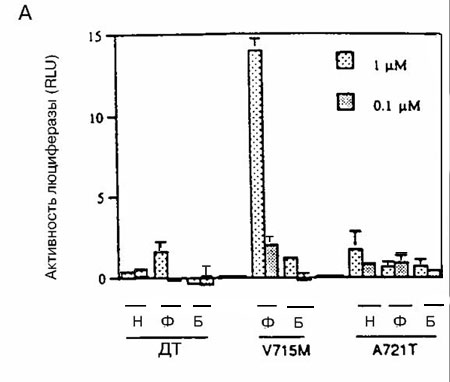
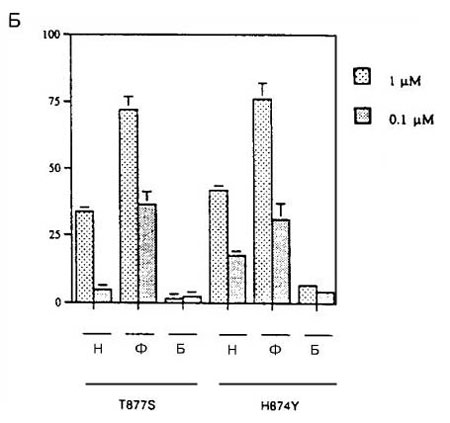
Рисунок 4 (A, Б). Ответ мутантных AP на антиандрогены
Мутантные AP преходящим образом экспрессировали в клетках CV-1, содержащих ген-регулятор люциферазы, затем их инкубировали в присутствии или в отсутствие нилутамида (Н), гидроксифлутамида (Ф) и бикалутамида (Б) в указанных концентрациях. Исследовали следующие АР: рисунок А) – дикого типа (ДТ), мутантные А721М и V715М; рисунок Б) - H874Y и T877S. Все измерения проводили четырежды; показаны результаты репрезентативных экспериментов с ошибкой среднего. В этих экспериментах максимальный ответ на ДГТ отмечен со стороны АР ДТ, который достиг 341 RLU.
Эти эксперименты также подтверждают, что флутамид может действовать как слабый агонист АР дикого типа (рисунок 4А). Слабая активность гидроксифлутамида в качестве агониста также отмечена другой группой авторов. Такая активность может и не играть роли при первичном андроген?независимом раке предстательной железы, который развивается при относительно высоких уровнях ДГТ. Однако кастрация может приводить к отбору клеток, содержащих АР дикого типа, в которых активность повышена из?за сверхэкспрессии АР, изменений белков, связанных с АР или по другим механизмам.Появление такой популяции флутамид?зависимых клеток, экспрессирующих АР дикого типа, может служить дополнительным фактором в развитии синдрома отмены флутамида. Более того, клетки, которые первоначально обладали зависимостью от флутамида, могли измениться до разной степени независимости от этого препарата, что также объясняет неудачные исходы лечения флутамидом.Наконец, следует отметить, что эффекты агонистов АР дикого типа, а также агонистов мутантных АР реализуются при уровне сывороточных концентраций гидроксифлутамида, которые наблюдаются у больных.
Тот факт, что бикалутамид сохраняет антагонистические свойства в отношении реагирующих на флутамид мутантных АР, идентифицированных в нашей работе, и не обладает слабой активностью как агонист АР дикого типа, предполагает, что этот препарат может оказаться эффективным у некоторых больных с АН?раком предстательной железы.Более того, если во время лечения флутамидом изменяются биологические свойства новых поколений клеток рака предстательной железы и происходит выживание гормонально?независимых клеток, тогда бикалутамид может оказаться особенно эффективным у больных, леченных флутамидом.Однако какова доля больных с АН?раком предстательной железы, которых первоначально лечат с помощью кастрации или кастрации в комбинации с флутамидом, который особенно активен при мутациях АР, остается неясным.Доля больных, леченных флутамидом, у которых развивается синдром отмены флутамида как показатель изменения свойств АР, тоже неодинакова в разных исследованиях.
Наконец, недавние публикации о синдроме отмены бикалутамида предполагают, что этот препарат может также отбирать определенные типы АР после длительного применения.Следовательно, насколько эффективен бикалутамид у какой?либо доли больных с АН?раком предстательной железы, необходимо установить в клинических исследованиях.
Авторы: Мэри Энн Фентон, Тодд Д. Шастер, Алексис М. Фертиг, Мэри?Эллен Тэплин, Гирт Колвенбаг, Гленн Дж. Бабли и Стивен П. Бок
Программа биологии рака, Отделение гематологии и онкологии, Терапевтическое отделение, Медицинский центр Госпиталя Бен Израэл и Гарвардский медицинский факультете, Бостон, Массачусетс 02215 [M. A. F., T.D.S., A.M.F., G.J.B., S.P.B]; Отделение гематологии и онкологии, Медицинский факультет Массачусетского университета, Уорсестер, Массачусетс 01655 [M?E, T]; и Зенека Фармасьютиклз, Уилмингтон, Делавэр 19803 [G.K.]



