Нейробластома – злокачественная опухоль, которая развивается из эмбриональных ней-робластов симпатической нервной системы. Это одна из наиболее часто встречающихся опу-холей детского возраста (7,5% всех злокачественных новообразований у детей) [2]. Заболе-ваемость составляет 6-8 человек на 1 миллион детского населения до 15 лет [2; 4].
Наиболее часто нейробластома локализуется: в надпочечнике (32%), забрюшинном про-странстве (28%), средостении (15%), области малого таза (5,6%), на шее – 2%. В 70% случаев уже при установлении первичного диагноза выявляются отдаленные метастазы, чаще всего в костный мозг (81%), кости (69%), и лимфатические узлы (65%), реже – в печень (19%) легкие (10%) и как исключение в ЦНС (8%) [2; 3].
Гистологическое строение нейробластомы представляет большой теоретический и прак-тический интерес. Различают 3 типа опухолей, отличающихся друг от друга степенью кле-точной дифференцировки: симпатогониомы, симпатобластомы и ганглионейробластомы [1].
В последние годы в большинстве стран проводятся исследования по диагностике и
лечению локализованных и местно-распространенных форм нейробластом, основанные на оценке молекулярно-генетических и иммуногистохимических особенностях опухоли. Важнейшими прогностическими факторами для нейробластомы, используемые для оп-ределения группы риска и назначения лечения, являются стадия, возраст, иммуногистохимические и молекулярно-генетические характеристики опухоли. В основе исследований лежит идея показать, что уменьшение интенсификации и сроков лечения детей, больных нейробластомой, не ухудшает результатов терапии. При лечении больных с нейробластомой применяются три метода: хирургический, лекарственный и лучевой. Программа лечения зависит от распространенности процесса, что зависит от стадии и степени риска заболевания.
Основным методом является хирургический, поскольку при исследовании структуры опухоли после ее удаления и определении группы риска, оперативное лечение может быть единственно необходимым компонентом. А с внедрением в нашей клинике эндоскопической хирургии сокращается длительность операции, послеоперационная травма и сроки пребывания ребенка в стационаре.
В связи с внедрением лапароскопической хирургии в онкопедиатрию, представляет ин-терес наше клиническое наблюдение.
Ребенок Т., 9 мес., поступил в хирургическое отделение опухолей торако-абдоминальной локализации НИИ детской онкологии и гематологии РОНЦ им. Н.Н. Блохина РАМН (НИИ ДОГ) в апреле 2008 года с диагнозом: опухоль левого надпочечника.
Из анамнеза известно, что ребенок от первой беременности, протекавшей физиологиче-ски. Родился в срок. Период новорожденности протекал без особенностей. С возраста 8 ме-сяцев у ребенка отмечались периодические расстройства стула, в связи, с чем участковым педиатром направлен на ультразвуковое исследование органов брюшной полости и забрю-шинного пространства, при котором выявлено объемное образование левого надпочечника. Пациент направлен в НИИ ДОГ.
При обследовании ультразвуковой томографии и рентгеновской компьютерной томо-графии с в/в болюсным контрастированием органов брюшной полости, забрюшинно-го пространства: паравертебрально слева, на уровне ThХ-II позвонков определялось объемное образование размерами 5,7х4,5х5,3см с четкими контурами, неравномерно накапливающее контрастное вещество. Новообразование прилежит к верхнему полюсу левой почки, левой ножке диафрагмы, нижнему полюсу селезенки, хвосту поджелудочной железы, аорте и чрев-ному стволу. Селезеночные сосуды оттеснены кпереди. Заключение: объемное образование левого надпочечника, вероятнее всего нейрогенной природы.
Данные исследования с метилйодбензилгуанидином: определялось повышенное накоп-ление радиофармпрепарата соответственно образованию забрюшинного пространства слева, что свидетельствует о наличии активной специфической ткани нейрогенной природы в ука-занной области.
Миелограмма, рентгенография и РКТ органов грудной клетки – без патологии.
На первом этапе, согласно программе лечения локализованных и местно-распространенных нейробластом, учитывая возраст ребенка и локализованную стадию, а также размеры опухоли, принято решение о выполнении оперативного вмешательства в объ-еме лапароскопической адреналэктомии слева.
Под интубационным наркозом 28.04.08 была произведена лапароскопическая адрена-лэктомия слева. Ребенка на операционном столе уложили на противоположный пораженному надпочечнику бок. Валик находился на уровне проекции мечевидного отростка. Давление СО2, искусственно нагнетаемое в брюшную полость, составило 9 мм ртутного столба. Мы установила 3 порта: 10 мм – параумбиликально для лапароскопа, 5 мм – в эпигастральной области по средне-ключичной линии, 10 мм – в правой подвздошной области для манипуляторов. Использовали специальные эндоскопические инструменты: ультразвуковой скальпель, моно- и биполярный коагулятор. На первом этапе выполнена мобилизация селезеночного изгиба ободочной кишки (рис. 1).
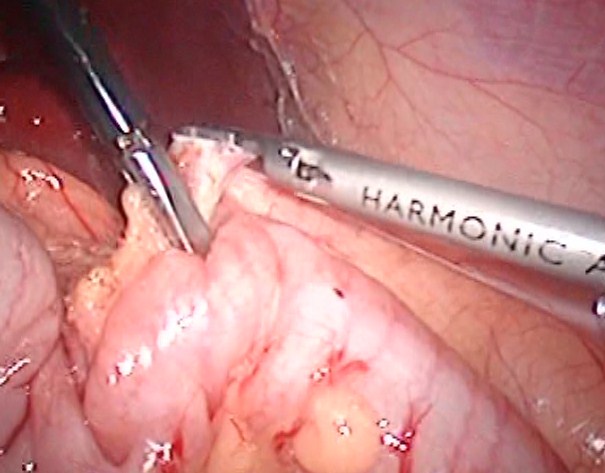
Рис.1 Мобилизация ободочной кишки.
На втором этапе произведено выделение надпочечника из окружающих тканей (рис. 2).
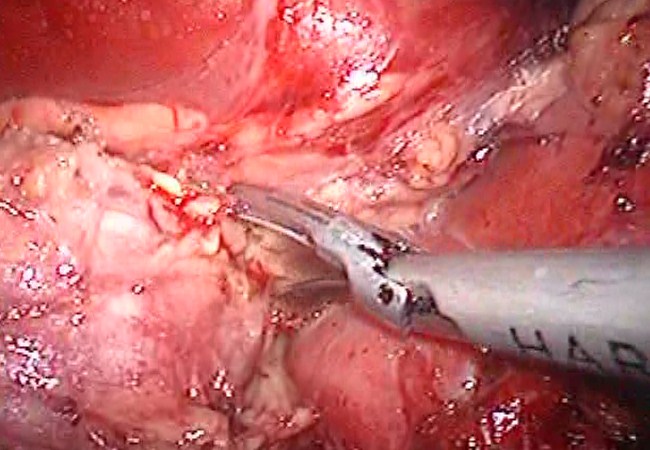
Рис.2 Мобилизация надпочечника.
На третьем – выделение сосудистой ножки надпочечника. С помощью эндоскопического клипатора питающие сосуды были лигированы и пересечены (рис. 3).
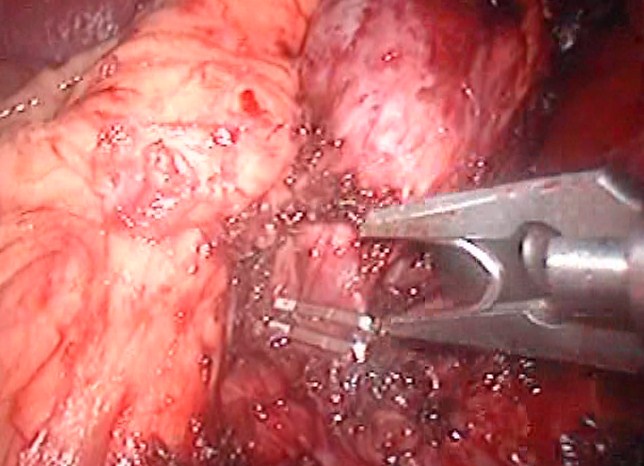
Рис.3 Клипирование надпочечниковой вены
Моноблочно опухоль удаленна (рис.4), погружена в контейнер и эвакуирована через разрез, увеличенный до 4 см, в месте установленного ранее порта в левой подвздошной области. Через порт в ложе удаленной опухоли установлен дренаж.
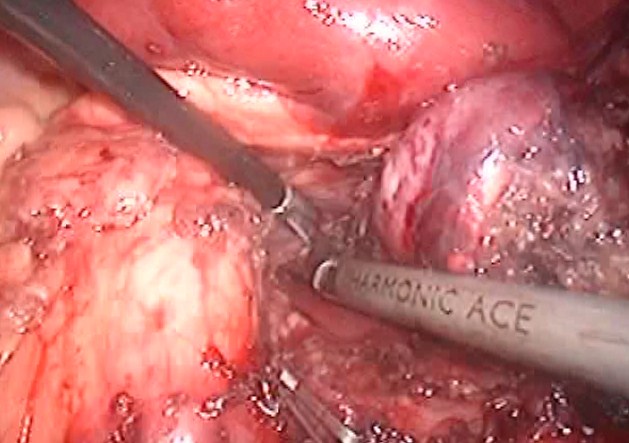
Рис.4 Удаление надпочечника
Рана послойно ушита, косметические внутрикожные швы. Время оперативного вмешательства составило 55 мин. Кровопотери не было. Ребенок экстубирован на операционном столе.
Послеоперационный период протекал гладко. На следующие сутки пациент переведен из реанимационного отделения в палату. Дренаж удален через 18 ч после операции.
Гистологическое, молекулярно-генетическое и иммуногистохимическое исследования опухоли: нейробластома, недифференцированный тип, бедный стромой, индекс митоз-кариорексис=120, гистологическая степень злокачественности 3. Амплификации гена N-MYC не обнаружено. На основании данных исследований ребенок был отнесен в низкую группу риска. Следовательно, дальнейшее специальное лечение не показано, рекомендовано динамическое наблюдение. Выписан домой в удовлетворительном состоянии на 11 сутки после операции.
Сроки наблюдения составили 1 год. По результатам последнего комплексного обследования, данных за рецидив заболевания нет.
Таким образом; приведенное наблюдение демонстрирует возможности и эффективность лапароскопической хирургии в онкопедиатрии. Возраст ребенка при соответствующих размерах опухоли не является противопоказанием для выполнения малоинвазивного видеохирургического вмешательства.
Список литературы:
1. Дурнов Л.А., Голдобенко Г.В. Статистика злокачественных новообразований у детей. В кн.: Руководство по деткой онкологии. – 2003. – С. 361-76.
2. Черствой Е.Д. Опухоли симпатической нервной системы. В кн.: Опухоли и опухолепо-добные процессы у детей. Минск: Асар. – 2002. – С. 125-138.
3. Hiyama E., Iehara T., Sugimoto T. et al. Effectiveness of screening for neuroblastoma at 6 months of age: a retrospective population-based cohort study // Lancet. – 2008. – Vol. 371. – P. 1173-80.
4. Howman-Giles R., Shaw P., Uren R., Chung D. Neuroblastoma and other neuroendocrine tu-mors // Semin. Nucl. Med. – 2007. – Vol. 54. – P. 268-302.
Авторы: А.В. Волобуев, А.Б. Рябов, М.А. Рубанский, М.В. Рубанская, А.П. Казанцев, П.А. Керимов, Е.И. Бойченко, М.А. Рахоев



