 Цетуксимаб (Эрбитукс) при плоскоклеточном раке головы и шеи
Цетуксимаб (Эрбитукс) при плоскоклеточном раке головы и шеи
Плоскоклеточный рак головы и шеи (РГШ) остается одним из основных видов злокачественных опухолей и причин смерти от онкологических заболеваний во всем мире. В 2006 г. было зарегистрировано более 600 000 новых случаев заболевания РГШ [1].
Адекватный локальный контроль является основной гарантией успеха лечения локализованного и местно-распространенного РГШ. В отличие от многих злокачественных опухолей при РГШ многие пациенты умирают не от диссеминации процесса, а от локорегионарного прогрессирования без отдаленных метастазов. Более чем в 50% случаев смерть больных РГШ обусловлена только локорегионарным прогрессированием, а почти 90% больных с отдаленными метастазами имеют и персистирующий местный процесс, нередко самостоятельно приводящий к смерти больного. С 1960-х до 1980-х годов хирургия и лучевая терапия оставались основными методами лечения РГШ. К сожалению, вследствие местно-распространенного (в большинстве случаев) характера поражения оперативное вмешательство носило расширенно-комбинированный характер, а образующийся в результате последнего дефект (см. рисунок) делал невозможным последующую социальную адаптацию больного и мог приводить к нарушению нормальной жизнедеятельности органов и систем в области головы и шеи.
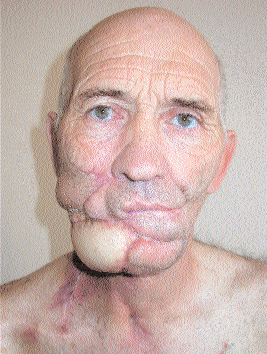
Больной раком головы и шеи после хирургического лечения
Функциональные и косметические последствия хирургического лечения были столь неудовлетворительны, что существовала острая потребность в поиске новых методов лечения, способных улучшить качество жизни больных [2]. Ранние исследования показали, что лучевая терапия, позволяющая многим больным избежать калечащих операций, к сожалению, уступает хирургическому методу (± послеоперационная лучевая терапия) в отношении отдаленных результатов лечения [3]. Добавление к радикальной лучевой терапии химиотерапии позволило как минимум «сравнять» отдаленные результаты консервативного (химиолучевого) и хирургического лечения и одновременно добиться сохранения пораженных органов у многих пациентов.
Плоскоклеточный РГШ стал одной из очень немногих солидных опухолей, при которых «консервативным» методам лечения удалось практически заменить хирургию, оставив за последней лишь лечение больных с локализованными формами болезни (Т1—2) и резистентным течением заболевания. Наиболее часто в настоящее время используется конкурентное (одновременное) проведение химиотерапии и лучевой терапии, позволяющее добиться потенцирования лечебного воздействия обеих методик за счет радиосенсибилизирующего эффекта химиотерапии. К сожалению, такой подход не только потенцирует противоопухолевый эффект, но и усиливает токсичность лечения, так как большинство цитостатиков, активных при РГШ, обладают перекрестной токсичностью с лучевой терапией (мукозиты, миелосупрессия) [4]. Учитывая, что многие пациенты с РГШ (особенно местно-распространенным) находятся в малоудовлетворительном состоянии или имеют сопутствующие заболевания, конкурентное проведение химиотерапии зачастую приводит к значительным нарушениям в графике лечения. Побочные эффекты лечения также могут представлять существенную угрозу для жизни больных, особенно при недостаточно хорошо организованном поддерживающем лечении.
В 1990-х годах были получены обнадеживающие данные об эффективности индукционной (перед лучевой терапией) химиотерапии, позволяющей добиться результатов, сопоставимых с таковыми при хирургическом лечении с последующей лучевой терапией [3, 5]. Основным преимуществом индукционной химиотерапии можно считать отсутствие «потенцирования» токсичности и возможность выполнить оба вида лечения (химиотерапия и лучевая терапия) в полном объеме. Однако, к сожалению, обратной стороной такого подхода является отсутствие радиосенсибилизирующего эффекта. Как показал метаанализ, проведение конкурентной химиолучевой терапии позволяет увеличить общую выживаемость больных РГШ на 8% по сравнению с проведением только лучевой терапии. Индукционная химиотерапия (с включением цисплатина и 5-фторурацила) улучшает общую выживаемость, однако ее эффект менее выражен и составляет около 5% [6]. Несмотря на то что в настоящее время опубликовано несколько рандомизированных исследований, показавших высокую эффективность индукционной терапии с включением таксанов [7—10], конкурентное проведение химиотерапии и лучевой терапии остается доминирующим подходом к лечению больных плоскоклеточным РГШ [11—14]. Однако весьма остро стоял вопросо необходимости поиска препаратов, потенцирующих эффект, но не токсичность лучевой терапии при использовании в конкурентном режиме. Такой подход позволил бы расширить контингент больных, подлежащих лечению (например, ослабленные и пожилые больные), и проводить его более безопасно.
Как свидетельствуют многочисленные исследования, практически во всех случаях плоскоклеточного РГШ наблюдается гиперэкспрессия рецепторов эпидермального фактора роста 1-го типа (EGFR) [15—18]. Высокий уровень экспрессии данного рецептора при РГШ, как и при других опухолях, сочетается с неблагоприятным прогнозом, более того, лучевая терапия приводит к дальнейшему усилению экспрессии и нарастанию резистентности. Блокада EGFR позволяет не только восстановить чувствительность опухолевых клеток к воздействию лучевой терапии, но и сенсибилизировать их к воздействию облучения [19, 20].
Цетуксимаб (Эрбитукс), представляющий собой моноклональные антитела класса G1 (IgG1) к внеклеточному домену EGFR, показал свою способность увеличивать чувствительность плоскоклеточного РГШ к облучению как в предклинических, так и в ранних клинических исследованиях [21—23]. На основании этих результатов было проведено хорошо организованное рандомизированное исследование III фазы, данные которого послужили поводом для регистрации препарата по этим показаниям [24].
Таблица 1. Шкала Карновского
| Баллы | Значение |
| 100 | Состояние нормальное, жалоб нет |
| 90 | Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 | Нормальная активность с усилием |
| 70 | Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 | Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей |
| 50 | Нуждается в значительной помощи и медицинском обслуживании |
| 40 | Инвалид. Нуждается в специальной помощи, в том числе медицинской |
| 30 | Тяжелая инвалидность, нуждается в госпитализации, хотя смерть не угрожает |
| 20 | Тяжелый больной. Госпитализация необходима. Необходимо активное лечение |
| 10 | Умирающий |
В исследование включали больных III или IV стадией по классификации AJCC (без отдаленных метастазов) [25] плоскоклеточного рака ротоглотки, гортаноглотки и гортани. Для включения в исследование больные должны были быть потенциально способны перенести интенсивную радиотерапию, иметь общее состояние по шкале Карновского (табл. 1) не менее 60, нормальную кроветворную функцию костного мозга, адекватную функцию печени и почек. Важно отметить, что включение больных со статусом менее 80 редко встречается в исследованиях, предусматривающих интенсивное лечение.
Таким образом, контингент больных, включенных в исследование, гораздо точнее представлял общую популяцию больных РГШ, чем в большинстве исследований по химиолучевому лечению. В исследование не включали больных, ранее имевших другие злокачественные новообразования или получавших лечение по поводу РГШ.
Перед включением в исследование проводилась тщательная оценка распространенности опухоли, в том числе с помощью панэндоскопии. В обязательном порядке проводились магнитнорезонансная или компьютерная томография головы и шеи, а также рентгенография органов грудной клетки. С целью адекватного питания в случае развития тяжелых мукозитов всем больным рекомендовалось выполнение чрескожной эндоскопической гастростомии. Все больные, включенные в исследование, должны были получить курс радикальной лучевой терапии на первичную опухоль и зоны регионарного метастазирования (7—8-недельный курс облучения). До регистрации пациента в исследовании лечащий врач должен был выбрать один из режимов фракционирования (табл. 2).
Лимфоузлы шеи, не вовлеченные в опухолевый процесс по данным клинического осмотра, облучали в СОД 50—54 Гр в зависимости от режима фракционирования. Конгломераты лимфатических узлов облучали в дозе, эквивалентной дозе для первичной опухоли. Если при регистрации пациента (но не постфактум) исследователь заявлял о желательности проведения лимфодиссекции шеи у пациентов с опухолями N2—3 (формально такая манипуляция рекомендована спустя 4—8 нед после завершения лучевой терапии), то доза на вовлеченные лимфоузлы сокращалась до 60 Гр. В случае неконтролируемой боли, обусловленной мукозитами вследствие лучевой терапии, допускалось не более двух 5-дневных перерывов за весь курс лечения. Таким образом, в исследовании предусматривалось максимально возможное соблюдение графика проведения лучевой терапии в обеих группах.
В группе, рандомизированной на получение цетуксимаба, данный препарат вводили дополнительно к лучевой терапии. В качестве премедикации перед каждой инфузией цетуксимаба вводили дифенгидрамин (димедрол) в дозе 50 мг. Первую (загрузочную) дозу 400 мг/м2 вводили за 1 нед до начала лучевой терапии, путем 2-часовой инфузии. Перед введением первой дозы препарата осуществляли тестовое введение 20 мг цетуксимаба путем 10-минутной инфузии с последующим 30-минутным периодом наблюдения. В случае развития реакций гиперчувствительности III—IV степени (по критериям СТСAE v. 3.0) цетуксимаб в дальнейшем не вводили, однако эти больные учитывались при финальном анализе данных в отношении эффективности лечения в группе цетуксимаб + лучевая терапия (принцип intention to treat). Далее препарат вводили еженедельно в дозе 250 мг/м2 путем 60-минутной инфузии. В случае развития токсичности лучевой терапии, требующей перерыва в облучении, график введения цетуксимаба не изменялся, и, наоборот, развитие токсичности, обусловленной цетуксимабом, не влияло на график подведения фракций лучевой терапии. Планирование и проведение лучевой терапии находилось под жестким контролем, предусматривающим изначальную оценку лечебного плана с его коррекцией в центральной исследовательской клинике. Адекватность подведения лучевой терапии оценивалась как соответствующая, имеющая малые отклонения, имеющая большие приемлемые отклонения, имеющая неприемлемые отклонения, согласно критериям Radiation Therapy Oncology Group (RTOG) [26, 27].
Таблица 2. Режимы лучевой терапии, использовавшиеся в исследовании
| Режим | Суммарная очаговая доза (СОД) Облучение 1 раз в день | Облучение 2 раза в день |
|---|---|---|
| Обычное фракционирование | 70 Гр 2 Гр за фракцию, за 35 фракций 5 фракций в неделю, 7 нед | Не использовалось |
| Ускоренное фракционирование | 72—76,8 Гр Не использовалось за 60—64 фракции | 1,2 Гр за фракцию, 10 фракций в неделю, 6—6,5 нед |
| Смешанное фракционирование с одновременным прицельным облучением | 72 Гр 32,4, 1,8 Гр за фракцию, за 42 фракции 5 фракций в неделю, 3,6 нед | Утренняя доза 21,6 Гр, 1,8 Гр за фракцию, 5 фракций в неделю, 2,4 нед. Вечерняя доза 18 Гр, 1,5 Гр за фракцию, 5 фракций в неделю, 2,4 нед |
В период лечения еженедельно осуществляли клинический осмотр, оценивали побочные эффекты, выполняли рутинные гематологические и биохимические анализы крови. Противоопухолевый эффект оценивали через 4 и 8 нед после завершения лечения.
Пациентов, включенных в исследование, стратифицировали по общему состоянию (статус по шкале Карновского 60—80 против 90—100), наличию поражения лимфатических узлов (N0 против N+), распространенности первичной опухоли (T1—3 против T4) и выбранной методике облучения. Первичной целью исследования являлась длительность локорегионарного контроля, оцениваемого как отсутствие признаков прогрессирования в зоне облучения (первичная опухоль и регионарные лимфатические узлы) при проведении плановых обследований. Вторичные цели исследования включали общую выживаемость, выживаемость без прогрессирования, общую частоту ремиссий и безопасность лечения. Оценка ремиссии проводилась по наибольшему сокращению опухоли за первый год наблюдения. Оценка эффективности проводилась на основании принципа «по намерению лечить» (intention-to-treat basis).
С 1999 до 2002 г. в исследование включены 424 пациента, которые были рандомизированно распределены на группу лучевой терапии (n=213) и группу лучевой терапии + цетуксимаб (n=211). Группы не различались между собой по основным прогностически значимым и демографическим характеристикам. Экспрессия EGFR была выявлена в опухолях 81% больных в группе лучевой терапии и у 79% больных в группе комбинированного лечения. Наиболее важные характеристики больных представлены в табл. 3. Большинство больных имели значительное распространение опухолевого процесса, более трети пациентов находились в малоудовлетворительном состоянии (состояние по шкале Карновского менее 80; см. табл. 3). Наиболее часто в исследовании использовался смешанный режим фракционирования (56% больных). Стандартное фракционирование использовалось у 26% больных, ускоренное — у 18%. В среднем больные в группе стандартного фракционирования получили 67,5 Гр, в группе ускоренного фракционирования — 74,2 Гр, в группе смешанного фракционирования — 71,2 Гр. Значимых различий в режимах и СОД лучевой терапии между исследуемыми группами не было. Соответствие плану лечения также было крайне высоким в обеих лечебных группах, неприемлемые отклонения от плана лучевого лечения были отмечены лишь у 6% больных в группе лучевой терапии и у 4% в группе комбинированного лечения. Более 90% больных, рандомизированных в группу комбинированного лечения, получили цетуксимаб в запланированных дозах и режиме. На момент публикации исследования медиана длительности наблюдения за больными составила 54 мес. По результатам исследования, пациенты, получавшие цетуксимаб и лучевую терапию, дольше не имели местного прогрессирования по сравнению с рандомизированными на проведение только лучевой терапии (медиана длительности локорегионарного контроля составила 24,4 против 14,9 мес; р=0,005; табл. 4).
Таким образом, добавление цетуксимаба к лучевой терапии позволило уменьшить абсолютный риск развития локорегионального прогрессирования на 13% (относительное снижение риска — на 32%). Добавление цетуксимаба также позволило улучшить общую выживаемость. Медиана общей выживаемости больных, получавших комбинацию цетуксимаба и лучевой терапии, составила 49 мес, в то время как у больных, получавших только лучевую терапию, — 29,3 мес (р=0,03). В исследовании было выявлено 26% снижение относительного риска смерти больных, получавших комбинированную терапию.
Медиана выживаемости без прогрессирования (локальное и/или отдаленные метастазы) составила 17,1 мес для больных из группы комбинированного лечения и 12,4 мес — для больных, получавших только лучевую терапию (р=0,006). Частота развития отдаленных метастазов не различалась между группами. Наиболее частыми областями метастазирования были легкие и кости.
Таблица 3. Характеристика больных, включенных в исследование
| Показатель | Лучевая терапия | Лучевая терапия + цетуксимаб |
|---|---|---|
| Статус по Карновскому ?80 | 34 | 30 |
| IV cтадия по AJCC | 76 | 74 |
| T4 | 31 | 29 |
| N3 | 11 | 7 |
| Первичная локализация опухоли ротоглотка гортань гортаноглотка | 63 24 13 | 56 27 17 |
Примечание. Данные представлены как процент больных.
Также в исследовании было показано, что комбинированное лечение приводит к статистически значимому увеличению частоты достижения ремиссий (полных и частичных) — 74 против 64% (р=0,02). Лишь 4 пациента прекратили лечение цетуксимабом сразу после первой тестовой дозы препарата в связи с развитием реакций гиперчувствительности. Введение цетуксимаба было прекращено досрочно еще у девяти пациентов (причем у восьми из них — в связи с угревидной сыпью III степени выраженности). Необходимо еще раз отметить, что и эти больные вошли в анализ эффективности лечения. Менее чем 5% больных потребовалось снижение дозы цетуксимаба, задержка очередного введения цетуксимаба потребовалась у 14% больных, в основном в связи с развитием сыпи. За исключением инфузионных реакций и сыпи, частота других побочных эффектов III степени и выше была одинаковой в обеих группах. Важно отметить, что цетуксимаб не потенцировал наиболее частые побочные эффекты лучевой терапии, приводящие к нарушению графика лечения, такие как мукозиты, ксеростомия, дисфагия, боль, потеря веса и ухудшение общего состояния. Ранние смерти (в период лечения и менее чем через 60 дней после его окончания) были отмечены у 12 и 11 больных из группы лучевой терапии и комбинированного лечения соответственно. Ни одна из смертей не была связана с использованием цетуксимаба.
Таким образом, в исследовании было выявлено значимое улучшение результатов лечения (как непосредственного эффекта, так и выживаемости) при добавлении цетуксимаба к лучевой терапии, проводимой по радикальной программе (с целью излечения) у пациентов с плоскоклеточным РГШ. Данное улучшение всех показателей выживаемости было достигнуто в группе больных, включающей пациентов со статусом Карновского менее 80, без увеличения локальной токсичности лучевой терапии, наиболее часто лимитирующей ее проведение. Степень улучшения, достигнутого от добавления цетуксимаба (абсолютное 10% улучшение 3-летней общей выживаемости), превышает таковую, достигнутую в большинстве исследований, сравнивающих химиолучевую и лучевую терапию [28, 29]. Более того, у многих больных, включенных в исследование, использовалось гиперфракционирование лучевой терапии.
По данным ряда исследований, именно такой режим позволяет улучшить результаты лечения по сравнению со стандартной методикой облучения [30], однако добавление химиотерапии к гиперфракционированной лучевой терапии не приводит к дальнейшему улучшению результатов (в основном ввиду невозможности провести лечение в полном объеме из-за перекрестной токсичности) [31]. Важно отметить, что преимущество комбинированного лечения с включением цетуксимаба не может быть объяснено недостаточной эффективностью лучевой терапии в контрольной группе, так как она не уступает таковой в других сравнительных международных исследованиях [32, 33]. Цетуксимаб показал свою способность без значимого увеличения токсичности улучшать отдаленные результаты химиотерапии и при распространенном РГШ (рецидив заболевания, не подлежащий локальному лечению, или отдаленные метастазы). В исследование III фазы (EXTREME)
[34] были включены 440 подобных пациентов, имеющих отдаленные метастазы РГШ или рецидив болезни, не подлежащий локальному лечению. Больные были рандомизированы на проведение шести курсов химиотерапии (цисплатин 100 мг/м2 или карбоплатин AUC5 в 1-й день; 5-фторурацил 1000 мг/м2/сут, 24-часовая инфузия в 1—4-й дни; каждые 3 нед) с цетуксимабом или без в стандартном режиме (см. выше — в предыдущем исследовании). После окончания запланированного количества курсов химиотерапии больные, рандомизированные в группу цетуксимаб + химиотерапия, продолжали получать цетуксимаб до прогрессирования или развития непереносимой токсичности. Добавление цетуксимаба к химиотерапии привело к статистически значимому увеличению общей выживаемости больных, медиана которой в группе комбинированного лечения составила 10,1 мес против 7,4 мес в группе, получавшей только химиотерапию (р=0,036). Данные результаты представляются крайне важными не только потому, что впервые за 25 лет без значимого увеличения токсичности удалось добиться увеличения выживаемости больных распространенным РГШ по сравнению с платиносодержащей химиотерапией, но и потому что данное исследование послужило отправной точкой для изучения комбинации цетуксимаба с химиолучевым лечением при более ранних стадиях заболевания. Такой подход позволяет надеяться на дальнейшее улучшение результатов терапии РГШ, подлежащего локальному лечению у пациентов, способных перенести химиолучевую терапию. В настоящее время получены доказательные данные исследований II фазы [35, 36], позволяющие инициировать исследования III фазы по оценке эффективности и безопасности комбинации цетуксимаба с химиолучевым лечением.
Таблица 4. Выживаемость без локорегионарного прогрессирования
| Группа | 1 год | 2 года | 3 года |
|---|---|---|---|
| Лучевая терапия | 55 | 41 | 34 |
| Лучевая терапия + цетуксимаб | 63 | 50 | 47 |
С 2006 г. в большинстве экономически развитых стран мира цетуксимаб в комбинации с лучевой терапией входит в стандарты лечения местнораспространенного плоскоклеточного РГШ.
На основании результатов еще одного многоцентрового исследования, включившего 103 пациента с рецидивирующим или метастатическим плоскоклеточным РГШ, имеющих документированное прогрессирование болезни в течение 30 дней после окончания платиносодержащей химиотерапии, FDA было одобрено применение у данной когорты больных цетуксимаба в виде монотерапии. Большая часть (62%) больных на момент включения имели относительно удовлетворительное состояние (статус по Карновскому ? 80). Средний возраст включенных больных составил 57 лет, 82% из них были мужчины. Все включенные в это исследование больные получали цетуксимаб в виде монотерапии в стандартном режиме — загрузочная доза 400 мг/м2, далее по 250 мг/м2 еженедельно до прогрессирования или развития непереносимой токсичности. Частота объективных ответов составила 13% при медиане длительности эффекта 5,8 мес. Следует отметить, что уже сейчас многие зарубежные эксперты признают появление цетуксимаба одним из наиболее значимых достижений в лечении плоскоклеточного РГШ за последние 20—25 лет.
Цетуксимаб (Эрбитукс) при метастатическом колоректальном раке
Как уже неоднократно отмечалось, колоректальный рак является одним из наиболее ярких примеров успешности консервативной терапии при солидных опухолях. Благодаря внедрению ряда новых противоопухолевых препаратов (иринотекан, оксалиплатин, капецитабин, бевацизумаб и др.) в режимы первой и второй линий лечения медиана выживаемости больных колоректальным раком за последние несколько лет увеличилась почти в 4 раза. Согласно мнению большинства экспертов, такое увеличение произошло не благодаря какому-либо одному цитостатику или режиму лечения, а за счет возможности последовательного применения (в виде монотерапии или в комбинации) всех доступных в настоящее время эффективных лекарственных препаратов. Только такой подход, при котором достигается пусть и незначительный в абсолютном исчислении (увеличение медианы выживаемости на несколько месяцев) выигрыш от применения каждого препарата, дает пациенту шанс на максимальное продление достойной жизни. Однако, как это, вероятно, успели прочувствовать большинство онкологов, занимающихся лечением метастатического колоректального рака, наступает момент, когда все доступные препараты уже исчерпаны. При этом многие больные, у которых ранее достигался эффект на фоне проводимого лечения, остаются в прекрасном общем состоянии и не имеют серьезных проблем, обусловленных прогрессией опухоли или токсичностью предшествующей терапии. Для врача данный контингент больных представляется наиболее «психологически» тяжелым, так как приходится признавать, что уже ничем не можешь помочь вполне «здоровому» пациенту, которого лечил на протяжении нескольких лет. До недавнего времени онкологи США и Евросоюза имели в «запасе» на один эффективный препарат больше, чем онкологи из Российской Федерации. Регистрация Эрбитукса в РФ позволяет надеяться, что и наши пациенты теперь смогут получать максимально возможный объем эффективного лечения метастатического колоректального рака. Важно отметить, что если изначальная регистрация препарата в США и странах Евросоюза основывалась на данных двух исследований, показавших способность препарата индуцировать ремиссии у больных метастатическим колоректальным раком, исчерпавших другие возможности лечения, то в настоящее время опубликованы данные, подтверждающие способность цетуксимаба улучшать и выживаемость таких больных [37]. Цетуксимаб явился первым биологическим агентом, который продемонстрировал влияние на выживаемость предлеченных больных с метастатическим колоректальным раком при назначении в виде монотерапии.
В рандомизированном исследовании СО.17 цетуксимаб в стандартном режиме сравнивался с наилучшим сопроводительным (симптоматическим) лечением у пациентов, исчерпавших все возможные варианты лечения (включая иринотекан, оксалиплатин и фторпиримидины). Монотерапия позволила добиться 23% относительного снижения риска смерти (первичная цель исследования) и 32% снижения риска прогрессирования (вторичная цель исследования). В среднем общая выживаемость пациентов, получавших цетуксимаб, составила 6 мес против 4,5 мес в группе симптоматического лечения. Хотя 1,5-месячное увеличение выживаемости выглядит не столь значительно, не стоит забывать, что для конкретного пациента выигрыш в выживаемости может оказаться гораздо больше. Кроме того, исследование включало пациентов, резистентных ко всем активным при колоректальном раке цитостатикам, а выигрыш от всех новых препаратов, используемых в настоящее время для лечения метастатического колоректального рака (оксалиплатин, иринотекан, бевацизумаб), не превышал 4—6 мес даже в гораздо более благоприятной ситуации (I—II линия лечения).
В другом исследование (EPIC), включившем 1298 пациентов метастатическим колоректальным раком после прогрессирования на фоне оксалиплатинсодержащей терапии (II линия лечения), комбинация иринотекана с цетуксимабом позволила увеличить выживаемость без прогрессирования до 3,98 мес по сравнению с монотерапией иринотеканом (2,56 мес; р<0,0001). Частота ремиссий также была статистически значимо выше в группе комбинированного лечения (16 против 4%; р<0,0001). Хотя в исследовании и не было показано увеличения общей выживаемости (10,71 мес в группе комбинированного лечения против 9,99 мес в группе монотерапии иринотеканом), большинство экспертов склонны объяснять это тем, что около половины (42%) больных из контрольной группы в дальнейшем после прогрессирования получили цетуксимаб.
На сегодняшний день в США и Евросоюзе зарегистрированы следующие показания к применению цетуксимаба при метастатическом колоректальном раке.
- Цетуксимаб в монотерапии — для больных с EGFR+ метастатическим колоректальным раком, имеющих прогрессирование на оксалиплатин- и иринотекансодержащей химиотерапии, а также при непереносимости иринотекансодеражщих режимов лечения.
- Цетуксимаб в комбинации с иринотеканом — для больных с EGFR+ метастатическим колоректальным раком при неэффективности иринотекансодержащих режимов.
В 2007 г. на ASCO были представлены первые результаты исследования CRYSTAL (рандомизированное исследование III фазы по сравнительному изучению эффективности и переносимости химиотерапии в режиме FOLFIRI и комбинации FOLFIRI с цетуксимабом в I линии лечения метастатического колоректального рака) [38]. В исследование были включены 1217 больных с доказанной (по данным иммуногистохимического исследования) гиперэкспрессией EGFR. Выживаемость без прогрессирования (основная цель исследования) и частота полных и частичных ремиссий были значимо выше в группе комбинации FOLFIRI + цетуксимаб: 8,9 против 8 мес (р=0,0479) и 47 против 39% (р=0,005). Ввиду малого срока наблюдения говорить об общей выживаемости пока не представляется возможным. С учетом того, что в подобные исследования включаются пациенты с заведомо нерезектабельными проявлениями болезни, одним из основных результатов исследования можно считать данные об увеличении частоты выполнения радикальных резекций метастазов в печень у пациентов, получавших комбинацию FOLFIRI + цетуксимаба — 4,3 против 1,5% (р=0,0034).Как свидетельствуют данные самых последних исследований, рекомендуемое перед назначением цетуксимаба иммуногистохимическое определение экспрессии EGFR не несет предсказательной информации в отношении эффективности препарата, и поэтому его рутинное выполнение нецелесообразно.
В связи с этим все более насущным становится поиск иных маркеров, предсказывающих эффективность препарата при метастатическом колоректальном раке. Выделение пациентов, которые имеют максимальный шанс на противоопухолевый эффект, позволило бы использовать цетуксимаб наиболее рационально. По данным большинства исследований, важным фактором, предсказывающим эффективность лечения с включением цетуксимаба, явилось наличие кожной сыпи. Пациенты, имевшие данный побочный эффект, отвечали на лечение примерно в 55% случаев, в то время как больные, не имевшие сыпи, — в 4—5% случаев.
Заключение
Эрбитукс, показав свою эффективность и удовлетворительную переносимость, рекомендован в разных странах мира для лечения местнораспространенного и метастатического плоскоклеточного РГШ и метастатического колоректального рака.
Авторы: Л.Г.Жукова, М.А.Кропотов, ГУ РОНЦ им. Н.Н.Блохина РАМН, Москва
По материалам журнала "Вместе против рака. Врачам всех специальностей" №3-4 2007 г.
emal A., Siegel R., Ward E. et al. Cancer statistics, 2006. CA Cancer J Clin 2006;56:106—30.
List M., Siston A., Haraf D. et al. Quality of life and performance in advanced head and neck cancer patients on concomitant chemoradiotherapy: a prospective examination. J Clin Oncol 1999;17:1020—8.
Veterans Affairs Laryngeal Cancer Study Group. Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer. N Engl J Med 1991;324:1685—9.
Harari P.M., Ritter M.A., Petereit D.G., Mehta M.P. Chemoradiation for upper aerodigestive tract cancer: balancing evidence from clinical trials with individual patient recommendations. Curr Probl Cancer 2003;28:7—40.
Domenge C., Hill C., Lefebvre J. et al. Randomized trial of neoadjuvant chemotherapy in oropharyngeal carcinoma. Br J Cancer 2000;83:1594—8.
Pignon J., Bourhis J., Domenge C. et al. Chemotherapy added to locoregional treatment for head and neck squamous cell cancer: three meta-analyses of updated individual data. Lancet 2000;355:949—55.
Posner M., Hershock D., Le Lann L. et al. A phase III multicenter trial of docetaxel cisplatin and 5-fluorouracil induction chemotherapy followed by chemoradiotherapy in patients with locally advanced squamous cell carcinoma of the head and neck. Program and abstracts of the American Society of Clinical Oncology 2006 Annual Meeting; June 2—6, 2006. Atlanta, Georgia. Special Scientific Session.
Remenar E., Van Herpen C., Germa Lluch J. et al. A randomized phase III multicenter trial of neoadjuvant docetaxel plus cisplatin and 5-fluorouracil versus neoadjuvant PF in patients with locally advanced, unresectable squamous cell carcinoma of the head and neck. Final analysis of EORTC 24971. Program and abstracts of the American Society of Clinical Oncology 2006 Annual Meeting; June 2—6, 2006. Atlanta, Georgia. Abstr 5516.
Calais G., Pointreau Y., Alfonsi M. et al. Randomized phase III trial comparing induction chemotherapy using cisplatinum, fluorouracil with or without docetaxel for organ preservation in hypopharynx and larynx cancer. Preliminary results of GORTEC 2000-01. Program and abstracts of the American Society of Clinical Oncology 2006 Annual Meeting; June 2—6, 2006. Atlanta, Georgia. Abstr 5506.
Hitt R., Lopez-Pousa A., Martinez-Trufero J. et al. Phase III study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer. J Clin Oncol 2005;23:8636—45.
Kramer S., Gelber R.D., Snow J.B. et al. Combined radiation therapy and surgery in the management of advanced head and neck cancer: final report of study 73-03 of the Radiation Therapy Oncology Group. Head Neck Surg 1987;10:19—30.
Bryce D.P., Ireland P.E., Rider W.D. Experience in the surgical and radiological treatment in 500 cases of carcinoma of the larynx. Ann Otol Rhinol Laryngol 1963;72:416—30.
Vokes E.E., Weichselbaum R.R., Lippman S., Hong W.K. Head and neck cancer. N Engl J Med 1993;328:184—94.
Garden A.S., Asper J.A., Morrison W.H. et al. Is concurrent chemoradiation the treatment of choice for all patients with Stage III or IV head and neck carcinoma? Cancer 2004;100:1171—8.
Mendelsohn J., Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol 2003;21:2787—99.
Dassonville O., Formento J.L., Francoual M. et al. Expression of epidermal growth factor receptor and survival in upper aerodigestive tract cancer. J Clin Oncol 1993;11:1873—8.
Eriksen J.G., Steiniche T., Askaa J. et al. The prognostic value of epidermal growth factor receptor is related to tumor differentiation and the overall treatment time of radiotherapy in squamous cell carcinomas of the head and neck. Int J Radiat Oncol Biol Phys 2004;58:561—6.
Ang K.K., Berkey B.A., Tu X. et al. Impact of epidermal growth factor receptor expression on survival and pattern of relapse in patients with advanced head and neck carcinoma. Cancer Res 2002;62:7350—6.
Liang K., Ang K.K., Milas L. et al. The epidermal growth factor receptor mediates radioresistance. Int J Radiat Oncol Biol Phys 2003;57:246—54.
Bonner J.A., Maihle N.J., Folven B.R. et al. The interaction of epidermal growth factor and radiation in human head and neck squamous cell carcinoma cell lines with vastly different radiosensitivities. Int J Radiat Oncol Biol Phys 1994;29:243—7.
Huang S., Harari P.M. Modulation of radiation response following EGFR blockade in squamous cell carcinomas: inhibition of damage repair, cell cycle kinetics and tumor angiogenesis. Clin Cancer Res 2000;6:2166—74.
Harari P.M., Huang S.M. Head and neck cancer as a clinical model for molecular targeting of therapy: combining EGFR blockade with radiation. Int J Radiat Oncol Biol Phys 2001;49:427—33.
Robert F., Ezekiel M.P., Spencer S.A. et al. Phase I study of anti-epidermal growth factor receptor antibody cetuximab in combination with radiation therapy in patients with advanced head and neck cancer. J Clin Oncol 2001;19:3234—43.
Bonner J.A., Harari P.M., Giralt J. et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006;354:567—8.
AJCC cancer staging manual. I.D. Fleming, J. Cooper, D. Henson (eds). 5th ed. Philadelphia, Lippincott-Raven; 1998.
Pajak T.F., Laramore G.E., Marcial V.A. et al. Elapsed treatment days - a critical item for radiotherapy quality control review in head and neck trials: RTOG report. Int J Radiat Oncol Biol Phys 1991;20:13—20.
Harari P.A. Phase II randomized trial of surgery followed by chemoradiotherapy plus C225 (cetuximab) for advanced squamous cell carcinoma of the head and neck: RTOG study 0234. Reston, Va. American College of Radiology, 2004.
Argiris A. Update on chemoradiotherapy for head and neck cancer. Curr Opin Oncol 2002;14:323—9.
Staar S., Rudat V., Stuetzer H. et al. Intensified hyperfractionated accelerated radiotherapy limits the additional benefit of simultaneous chemotherapy: results of a multicentric randomized German trial in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 2001;50:1161—71.
Bourhis J., Syz N., Overgaard J. et al. Conventional vs. modified fractionated radiotherapy: meta-analysis of radiotherapy in head & neck squamous cell carcinoma: a meta-analysis based on individual patient data. Int J Radiat Oncol Biol Phys 2002;54(Suppl 1):71—2.
Staar S., Rudat V., Stuetzer H. et al. Intensified hyperfractionated accelerated radiotherapy limits the additional benefit of simultaneous chemotherapy: results of a multicentric randomized German trial in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 2001;50:1161—71.
Adelstein D.J., Li Y., Adams G.L. et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003;21:92—8.
Denis F., Garaud P., Bardet E. et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 2004;22:69—76.
Vermorken J.B. Cetuximab extends survival of patients with recurrent or metastatic SCCHN when added to first-line platinum based therapy: results of a randomized phase III (EXTREME) study. Presented at: 43rd Annual Meeting of the American Society of Clinical Oncology; June 1—5, 2007. Chicago, IL. Oral Abstract session.
Merlano M., Numico G., Russi E.G. et al. Cetuximab (C-mab) and chemo-radiation (CT-RT) for loco-regional advanced squamous cell carcinoma of the head and neck (HNC): a phase II study [abstract]. J Clin Oncol 2007;25(18S):abstr 6043.
Wanebo H.J., Ghebremichael M., Burtness B. et al. Phase II evaluation of cetuximab (C225) combined with induction paclitaxel and carboplatin followed by C225, paclitaxel, carboplatin, and radiation for stage III/IV operable squamous cancer of the head and neck (ECOG, E2303). ASCO Meeting Abstracts 2007; 25: 6015.
American Association for Cancer Research 2007 Annual Meeting: Abstracts LB-1 and LB-2. Presented April 16, 2007.
Van Cutsem E., Nowacki M., Lang I. et al. Randomized phase III study of irinotecan and 5-FU/FA with or without cetuximab in the first-line treatment of patients with metastatic colorectal cancer (mCRC): the CRYSTAL trial [abstract]. J Clin Oncol 2007;25(18S):abstr 4000 and oral presentation.



