Веснин С.Г., Каплан М.А., Авакян Р.С.
ВНИИРТ, Москва; ГУ МРНЦ РАМН, Обнинск
Vesnin S.G., Kaplan M.A., Avakjan R.S.
All Russian Research Institute of Radio Electronic, Moscow;
Medical Radiology Research Center, Russian Academy of Medical Science, Obninsk
Введение
Микроволновая радиотермометрия - метод диагностики, основанный на измерении излучения тканей в микроволновом диапазоне. Интенсивность собственного излучения тканей в этом частотном диапазоне определяется их температурой и биофизическими параметрами. В отличие от широко известной инфракрасной термографии, которая измеряет температуру кожи, микроволновая радиотермометрия позволяет неинвазивно выявлять тепловые аномалии на глубине нескольких сантиметров. Впервые использовать для диагностики рака молочной железы информацию о собственном излучении тканей в микроволновом диапазоне предложил американский радиоастроном А. Barrett [1]. В дальнейшем, во многих странах были созданы научные школы, занимающиеся неинвазивным измерением внутренней температуры [2-6]. На заре развития этой технологии приборы представляли собой измерители температуры в одной точке и их называли радиотермометры. В настоящее время это современные диагностические комплексы, позволяющие визуализировать тепловую активность тканей, как на поверхности, так и внутри. Применительно к обследованию молочных желез все большее распространение получает термин «микроволновая маммография». Эта технология разработана ведущими российскими специалистами, сертифицирована в РФ и в ряде зарубежных стран, включена в стандарт медицинской помощи онкологическим больным [7-10]. Рентген – маммография и УЗИ дают врачу информацию о структурных изменениях – о размере опухоли, ее локализации, наличии микрокальцинатов и т.д. Микроволновая маммография дает врачу дополнительную «энергетическую» информацию о тепловой активности тканей, выраженности пролиферативных процессов, риске малигнизации и т.д. В настоящее время микроволновая маммография преимущественно используется в следующих направлениях:
- В алгоритме комплексной диагностики рака молочной железы (РМЖ).
- Проведение профилактических осмотров женского населения с целью выделения пациентов группы риска, требующих комплексного обследования.
- Оценка тепловой активности тканей молочной железы и мониторинг эффективности проводимого лечения доброкачественных заболеваний.
За последние 10 лет в России и в США проведено 7 клинических испытаний метода, с участием 1500 тысяч пациентов. Результаты измерения тепловой активности тканей сопоставлялись с данными гистологии (Таблица 1).
Результаты клинических испытаний микроволновой маммографии
Таблица 1
|
№ |
Место проведения |
Год |
Чувствительность, % |
Специфичность, % |
|---|---|---|---|---|
|
1 |
Городская клиническая больница №40, Москва, Россия |
1997 |
94,2 |
71,4 |
|
2 |
Филиал №1 Маммологичекого диспансера, Москва, Россия |
1998 |
85,1 |
76,5 |
|
3 |
РОНЦ, Москва, Россия |
1998 |
89,6 |
81,8 |
|
4 |
Госпиталь им. Бурденко, Москва, Россия |
2001 |
98 |
76,2 |
|
5 |
Филиал №1 Московского Маммологичекого диспансера, Москва, Россия |
2002 |
95,2 |
57,2 |
|
6 |
Medical College, Arkansas, USA |
2003 |
84,8 |
70,2 |
|
7 |
Центр Рентгенорадиологии, Россия, Москва |
2006 |
96,6 |
56,7 |
Эти исследования дали большой экспериментальный материал для оценки тепловых изменений внутри молочной железы в процессе злокачественного роста. Кроме этого накопился определенный опыт практического использования технологии в 150 российских и зарубежных центрах. В настоящей работе мы попытались дать теоретическое объяснение экспериментальным данным, полученным за последние годы.
Температура и темп роста злокачественной опухоли
Французский исследователь M. Gautherie в течении 16 лет изучал тепловые процессы в молочных железах [11-12] и в своих работах пытался дать ответы на следующие вопросы:
- От чего зависит температура злокачественной опухоли?
- Когда начинаются тепловые изменения при раке молочной железы?
Температуру внутри молочной железы он измерял инвазивно с помощью термопар, расположенных на конце иглы. Кроме измерения внутренней температуры, всем пациенткам делали маммографию и измеряли температуру кожи с помощью тепловизора. Всего в его базе данных было 80 тысяч пациентов, у 540 женщин он инвазивно измерил внутреннюю температуру. В процессе исследований он измерял температуру как внутри опухоли, так и в окружающих ее тканях. Кроме этого, он проводил измерения температуры в симметричных точках противоположной молочной железы. После измерения температуры с помощью специальных математических моделей Gautherie рассчитывал тепловыделение злокачественной опухоли – количество энергии, выделяемое одним кубическим сантиметром опухоли. На рис. 1 представлены экспериментальные данные тепловыделения злокачественной опухоли молочной железы в зависимости от ее времени удвоения (ВУ). Черные кружочки относятся к пациентам, у которых были выявлены метастазы в лимфоузлах, светлые кружочки относятся к пациентам без метастазов. Время удвоения (ВУ) согласно модели Шварца характеризует темп роста опухоли и равно интервалу времени, в течение которого опухоль удваивает свой объем. Из рисунка 1 следует, что тепловыделение (температура) злокачественной опухоли определяется ее временем удвоения. Наиболее опасные, быстро растущие опухоли, с малым ВУ, имеют большое тепловыделение, а индолентные, медленно растущие опухоли, с большим ВУ, имеют низкое тепловыделение и соответственно низкую температуру.
Зависимость тепловыделения злокачественной опухоли от времени удвоения (ВУ)
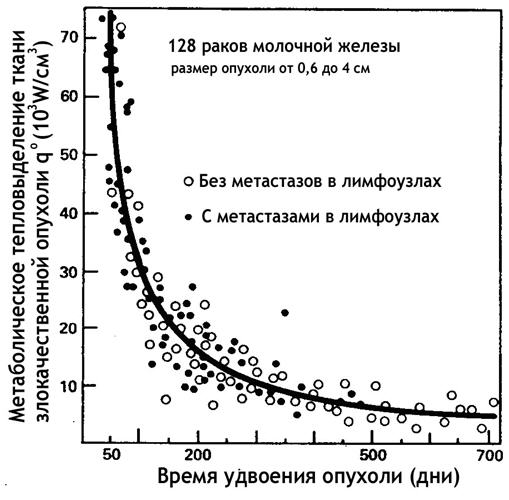
Рис.1
На рисунке 2 представлена кинетика роста опухоли, рассчитанная согласно модели Шварца, в зависимости от ее тепловыделения (времени удвоения). Для опухолей молочной железы с умеренным темпом роста время удвоения составляет 90-100 дней [13], что соответствует среднему значению тепловыделения 30-34 мВт/см3 . При этом доклиническая фаза развития опухоли составляет 7-8 лет.
Кинетика развития опухоли
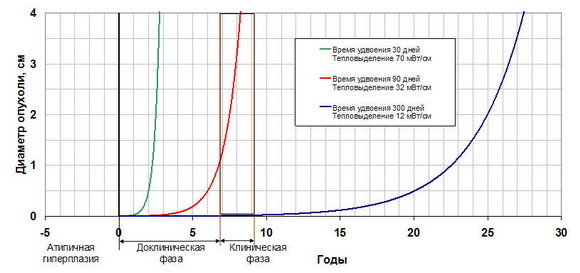
Рис.2
Для «горячих» опухолей со стремительным ростом (тепловыделение равно 70 мВт/см3, время удвоения 30 дней) доклинический фаза развития составляет всего 2 года. Следует отметить, что данные полученные Gautherie не противоречат общей концепции повышенного метаболизма злокачественной опухоли. Немецкий ученый O. Варбург еще в 1924 году обнаружил, что основной биохимической особенностью опухолевых клеток является их способность получать энергию за счет «молочнокислой ферментации» гликолиза и расти за счет энергии этого процесса [14]. Дыхание с использованием кислорода в раковых клетках заменяется на другой тип энергетики — ферментацию глюкозы. За эту работу он был удостоен Нобелевской премии. При интенсивном использовании анаэробного пути гликолиза рассеивается существенно больше энергии, что приводит к повышению температуры опухоли и окружающих тканей.
Второй важный вывод, который можно сделать из анализа данных, представленных на рис.1, связан с корреляцией между тепловыделением опухоли и метастазами в лимфоузлах. У 18 из 19 пациентов с высоким тепловыделением имелись метастаза в лимфоузлах. Вместе с тем, для опухолей с низкой тепловой активностью метастазы были выявлены только у 5 из 30 пациентов. Прогностический потенциал тепловых методов был также продемонстрирован Н.П. Напалковым и Н.Б. Кондратьевым [15], которые изучали выживаемость пациентов с РМЖ в зависимости от тепловых изменений на проекции опухоли, для разных стадий развития опухолевого процесса. Для оценки тепловых изменений была использована следующая классификация:
- «Термопозитивные опухоли» – опухоли, на проекции которых имело место существенное повышение температуры
- «Термонегативные опухоли» - опухоли, на проекции которых отсутствовало повышение температуры
- «Пылающие опухоли» - опухоли с очень большим повышением температуры (более 2 градусов)
На рис. 3 представлена данные по выживаемости для пациентов с 3б стадией рака молочной железы.
Выживаемость пациентов с РМЖ 3б стадии для пылающих и термонегативных опухолей
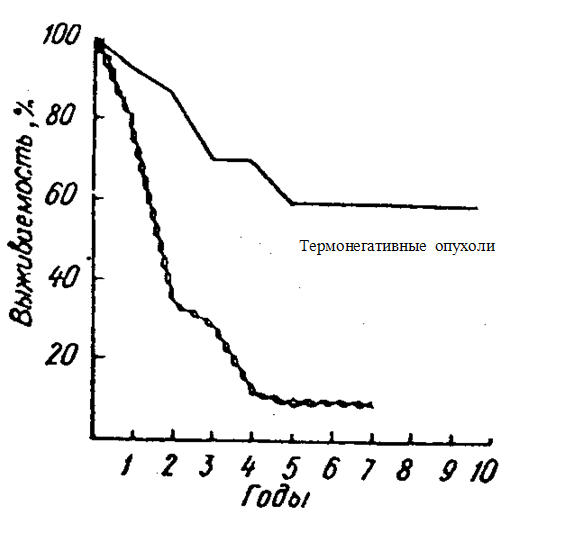
Пылающие опухоли
Рис.3
Для «пылающих опухолей» пятилетняя выживаемость составила 9 %, а у пациентов без повышения температуры на той же стадии развития опухолевого процесса выживаемость была в 6.5 раз выше и составляла 60 %.
Отчасти о прогностическом потенциале тепловых методов свидетельствуют исследования, проведенные в центре Рентгенорадиологии в 2006 году [7]. В рамках этих исследований оценивался уровень тепловых изменений на проекции опухоли в зависимости от степени ее злокачественности. Температура измерялась неинвазивно с помощью микроволнового радиотермометра РТМ-01-РЭС и оценивалась по шестибальной шкале. Тh0 - нет тепловых изменений, Тh5 – максимальные тепловые изменения. У 80% пациентов с высокой степенью злокачественности, имелись максимальные тепловые изменения (Th5). Для пациентов с низкой степенью злокачественности преобладали показатели Тh3 (50%). Таким образом, тепловые изменения хорошо коррелируют со степенью злокачественности. Вместе с тем, степень злокачественности является одним из важных независимых прогностических параметров. По данным Blamey [16] 90 % пациентов с низкой степенью злокачественности живут после операции 30 и более лет, а 90% пациентов с высокой степенью злокачественности живут не более 8 лет. Таким образом, информация о внутренней температуре злокачественной опухоли обладает значительным прогностическим потенциалом.
Кинетика тепловых процессов при РМЖ
Следующий важный вопрос, который интересует специалистов, связан с кинетикой тепловых процессов при РМЖ. Когда наступают тепловые изменения, связанные со злокачественным ростом? Для ответа на этот вопрос Gautherie выделил группу из 1245 пациентов, у которых по данным маммографии не было РМЖ, но уже были тепловые изменения на коже. У 461 женщин были доброкачественные изменения, а у 784 структурные изменения отсутствовали. В дальнейшем все эти пациенты в течение 12 лет проходили ежегодное маммографическое обследование. Через 8 лет у 38% пациентов без структурных изменений был выявлен рак молочной железы. Среди пациентов, у которых были доброкачественные изменения, этот процент достиг 44% [12]. Следует отметить, что процент выявленных РМЖ на порядок выше по сравнению с данными маммографического скрининга РМЖ у бессимптомных пациентов. В частности, в Англии за 10 лет при маммографическом скрининге одной тысячи женщин выявляется 36 случаев рака молочной железы (3.6%) [17]. По данным Gautherie для пациентов, имеющих тепловые изменения, процент выявленных РМЖ в течение 8 лет был на порядок выше. Таким образом, исследование, проведенное Gautherie, показало, что тепловые изменения предшествуют структурным изменениям, что открывает широкие возможности для проведения профилактических обследований и выявления пациентов группы риска. При этом надо учесть, что микроволновая маммография абсолютно безвредна, безболезненна и может применяться в любой возрастной группе. Важно также отметить, что микроволновая маммография выявляет в первую очередь быстрорастущие опухоли.
В исследованиях, проведенных в [7] было показано, что тепловые изменения наступают не тогда, когда опухоль достигает определенных размеров, а на стадии, предшествующей злокачественному росту. У 80% пациентов, у которых по данным гистологии не было выявлено клеток рака, но были атипичные клетки, уже имелись существенные тепловые изменения. Это повышение температуры нельзя объяснить повышенным метаболизмом злокачественных клеток, поскольку они не были обнаружены в процессе гистологического исследования. Вместе с тем, факт повышения тепловой активности тканей при выраженной мастопатии известен каждому специалисту, который занимается микроволновой маммографией.
Температура и плотность микроваскулярной сети
Оригинальное объяснение этому явлению дают исследования японских ученых [18], которые наряду с инвазивным измерением температуры злокачественной опухоли и окружающих тканей, измеряли плотность микроваскулярной сети – основной параметр, характеризующий ангиогенез опухоли. На рисунке 4 по вертикальной оси отложено повышение температуры тканей окружающих опухоль по сравнению температурой в симметричных точках противоположной молочной железы. По горизонтальной оси плотность микроваскулярной сети - число микрососудов в одном квадратном сантиметре тканей окружающих опухоль. Измерения проводились с помощью электронного микроскопа.
Взаимосвязь между температурой тканей, окружающих опухоль, и плотностью микроваскулярной сети
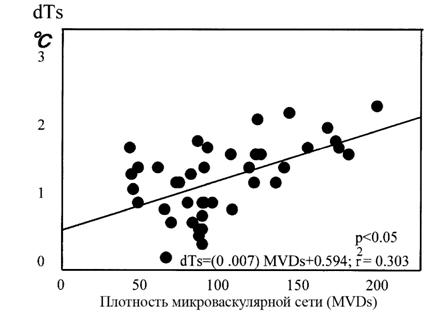
Рис.4
Видно, что повышение внутренней температуры тканей окружающих опухоль, хорошо коррелируют с плотностью микроваскулярной сети (MVDs). Таким образом, внутренняя температура может служить показателем ангиогенеза. Это очень важный вывод потому, что он подчеркивает, что повышение температуры тканей, окружающих опухоль, происходит при повышении плотности микроваскулярной сети. С другой стороны, в последние годы проведено большое число исследований плотности микроваскулярной сети при РМЖ и имеется большой экспериментальный материал, опираясь на который, можно судить о характере тепловых изменений внутренних тканей. В многочисленных исследованиях было показано, что рост опухоли зависит от ее способности формировать вокруг себя сосудистую сеть[19]. По мере роста опухоли клетки внутри нее отдаляются от источника питательных субстратов, необходимых для выживания и деления. В результате опухоль перестает расти, достигая стационарного объема (как правило, порядка 2–3 мм3), при котором увеличение клеточной массы компенсируется гибелью клеток из-за нехватки основных питательных веществ. В таком состоянии карцинома in situ может оставаться в течение многих лет [20]. Дальнейший ее рост возможен только после индукции ангиогенеза и скорость роста опухоли определяется плотностью микроваскулярной сети. Исследование, проведенное Weidner в 1991 году, показало, что плотность микроваскулярной сети прямо коррелирует с частотой метастазов у ряда солидных опухолей [21]. В [22] было показано, что плотность микроваскулярной сети в области наиболее активной васкуляризации является независимым и высоко достоверным прогностическим индикатором общей и безрецидивной выживаемости у пациентов с ранним раком молочной железы. С другой стороны, исследование плотности микроваскулярной сети для неинвазивных патологий показало, что MVD может служить клинически важным признаком для прогнозирования перехода от рака in situ к инвазивной карциноме [23]. Аналогичный вывод был сделан в [24], где изучалась связь плотности микроваскулярной сети в зависимости от гистологических характеристик неинвазивного рака. Показано, что комедо карцинома DCIS с высокой степенью злокачественности, для которой характерна высокая вероятность трансформации в инвазивный РМЖ достоверно ассоциируется (Р<0.001) c высокой плотность микрососудов. С учетом, того, что температура тканей, окружающих опухоль, коррелирует с плотностью микроваскулярной сети, можно полагать, что неинвазивные раки, имеющие высокий потенциал к инвазивной трансформации, будут иметь высокую температуру. В связи с этим необходимо обратить внимание на тот факт, что в рамках, проведенных в [7] неинвазивных измерениях внутренней температуры, у 50% раков in situ имелись очень сильные изменения на проекции опухоли (Th4, Th5), несмотря на незначительные размеры новообразования.
Весьма интересна работа французского исследователя [25], который оценивал риск развития рака молочной железы у пациентов с доброкачественными патологиями в зависимости от плотности микроваскулярной сети. Известно, что фиброзно-кистозная мастопатия характеризуется сравнительно низкой вероятностью малигнизации. Согласно данным R. Page [26], относительный риск малигнизации (RR) у пациентов с фиброзно кистозной мастопатией составляет 1.9. При наличии атипичных изменений эта величина увеличивается до 5.3. Согласно данным [25] у пациентов с фиброзно-кистозной мастопатией и высокой плотностью микроваскулярной сети относительный риск малигнизации находится в пределах от 7 до 11 единиц. Это даже выше чем при атипичных изменениях. К сожалению, это пока единственное подобное исследование, но оно показывает, что плотность микроваскулярной сети, а, следовательно, и температура может повышаться на стадии предшествующей злокачественному росту. Это открывает широкие возможности для проведения профилактических осмотров с использование микроволновой маммографии. Данные Gautherie по динамическому наблюдению за пациентами с тепловыми изменениями и современные исследования [7-10] демонстрируют большой потенциал микроволновой маммографии для выявления пациентов группы риска с целью дальнейшего комплексного дообследования.
Совместное использование микроволновой маммографии и рентген-маммографии
Известно, что доля раков молочной железы, выявленных между раундами скрининга (т. н. интервальные раки) является одним из важных показателей его эффективности. В Англии маммографический скрининг проводится уже около 30 лет и в нем участвует более 75% приглашенных женщин. По данным Наблюдательного Совета по скринингу из 36 раков, выявленных в течение 10 лет наблюдения за одной тысячью женщин, во время скрининговых осмотров выявляется 20 раков и 16 раков выявляется между раундами скрининга. Таким образом, доля интервальных раков в Англии составляет 33% от всех выявленных раков [17]. Сопоставимые данные были получены в других странах. В рамках рандомизированных испытаний в HIP проекте в Нью-Йорке доля интервальных раков колебалась от 19% до 36% [27]. В Стокгольмских испытаниях доля интервальных раков изменялась от 25% до 46% в зависимости от возрастной группы [28, 29]. Особенно высок уровень интервальных раков в возрастной группе 40-49 лет. По данным Шведских испытаний уровень интервальных раков в этой возрастной группе составляет 65.7% [30] , а по данным Стокгольмских испытаний 46% [28, 29]. Известно, что совместное использование рентген - маммографии и микроволновой маммографии снижает уровень ложноотрицательных результатов в 3-4 раза, и доводит чувствительность диагностики до 98% [9]. Это закономерный результат, поскольку микроволновая маммография легко выявляет быстрорастущие опухоли и уменьшает число ложноотрицательных заключений в возрастной группе 40-49 лет. Рентген-маммография, в свою очередь, выявляет раки, пропущенные микроволновой маммографией (опухоли с низкой степенью злокачественности).
Мониторинг эффективности лечения мастопатии– одна из наиболее интересных областей использования микроволновой маммографии
Огромный потенциал микроволновой маммографии заключается в оценке состояния молочных желез и в контроле за ходом лечения доброкачественных заболеваний. Малейшие изменения состояния молочных желез отражаются на тепловой активности тканей. Важно отметить, что тепловые изменения, в отличие от структурных, могут проявляться уже через 10-15 дней после начала лечения. Кроме этого, метод позволяет оценить происходит ли повышение тепловой активности тканей (воспалительный процесс, пролиферация, злокачественный рост) или имеют место процессы, сопровождающиеся понижением температуры (например, фиброзные изменения). У пациентов с фиброзно кистозной мастопатией в отсутствии выраженной пролиферации тепловые изменения незначительны и практически не отличаются от возрастной нормы. При воспалительных или пролиферативных процессах тепловая активность тканей повышается. У 80% пациентов с атипичными изменениями имеют место сильные тепловые изменения тканей (Th3-Th5) [7]. Таким образом, наблюдая за пациентами с доброкачественными патологиями, врач может выбирать тактику проводимого лечения. Сказанное в полной мере относится и оценке влияния гормональной терапии на состояние молочных желез. Кроме этого, необходимо учесть абсолютную безвредность метода, безболезненность и наглядность в представлении результатов, возможность использовать метод многократно, в любой возрастной группе, при беременности и лактации.
Заключение
В конце прошлого века инфракрасная термография была признана недостаточно эффективной для практического использования в маммологии. Этот факт, безусловно, сказывается на отношении специалистов к микроволновой маммографии. Но очевидно, что микроволновая маммография сделала огромный шаг вперед по сравнению с тепловидением, поскольку она позволила заглянуть вглубь молочной железы. Микроволновая маммография позволяет оценивать тепловые изменения как внутри молочной железы, так и на ее поверхности. Очевидно, что она не может заменить рентген-маммографию или УЗИ, поскольку она не дает информации о структурных изменениях молочной железы, которые крайне необходимы врачу. Вместе с тем, она может дать дополнительную «энергетическую» информацию о выраженности пролиферативных процессов, о тепловой активности ткани в «подозрительной» области. Эта информация во многих случаях может быть решающей при выработке тактики лечения. Безусловно, для понимания кинетики развития опухоли информация о ее энергетики крайне важна и микроволновая маммография позволяет с этой стороны взглянуть на процесс злокачественного роста.
Литература
- Barrett A. H., Myers Ph. C., “Subcutaneous Temperature: A method of Noninvasive Sensing” // Science, Nov.14, 1975, vol. 190, pp.669-671
- Leroy Y., Bocquet B., Mammouni A. “Non-invasive microwave radiometry thermometry” Physiol. Means. 19 (1998), p. 127-148
- Carr K.L. “Microwave Radiometry: It’s Importance to the Detection of Cancer.” IEEE MTT, vol. 37, № 12, Dec. 1989
- Годик Э.Э., Гуляев Ю.В. Человек глазами радиофизики // Радиотехника, 1991,8, с.51
- Троицкий В.С. К теории контактных радиотермометрических измерений внутренней температуры тел. // Изв. вузов. Сер. Радиофизика. - 1981.- т.24,. №9- с.1054
- Терентьев И.Г., Комов Д.В., Ожерельев А.С., Ориновский М.Б. Радиотермометрия в комплексной диагностике и оценке эффективности лечения опухолей молочной железы // Н. Новгород, "Нижегородская ярмарка", 1996 - с. 9-35
- Рожкова Н.И., Смирнова Н.А., Назаров А.А Радиотермометрия молочной железы и факторы, влияющие на ее эффективность // Опухоли женской репродуктивной системы, №3, 2007, с. 21-25
- Бурдина Л.М., Пинхосевич Е.Г., Хайленко В.А., Бурдина И.И., Веснин С.Г., Тихомирова Н.Н. Радиотермометрия в алгоритме комплексного обследования молочных желез //Современная онкология» 2006, Том 6, №1, с. 8-10
- Бурдина Л.М., Пинхосевич Е.Г., Хайленко В.А., Бурдина И.И., Веснин С.Г., Тихомирова Н.Н. Сравнительный анализ результатов обследования больных РМЖ по данным рентгено-маммографического и радиотермометрического обследований // Современная онкология 2006, Том 6, №1, с. 8-10
- Мустафин Ч.К. Радиотермометрические основы исследования молочных желез // Медицинская визуализация, №3, 2006, с. 32-38
- Gautherie M. “Temperature and Blood Flow Patterns in Breast Cancer During Natural Evolution and Following Radiotherapy” // Biomedical Thermology, 1982, p. 21 – 64
- Gautherie M., Gros C. M. “Breast Thermography and Cancer Risk Prediction,” // Cancer, vol. 45, 1980, p. 51-56
- Моисеенко В.М., Семиглазов В.Ф. Кинетические особенности роста рака млочной железы и их значение для раннего выявления опухоли // Маммология, №3, 1997, с.3-12
- Warburg O. “Oxygen, The Creator of Differentiation, Biochemical Energetics” // Academic Press, New York , 1966
- Напалков Н.П., Кондратьев В.Б. Термографический метод в оценке прогноза злокачественных новообразований // Тепловидение в медицине: Труды Всесоюзной конференции. "ТеМП-82". - Л.: ГОИ, 1984, с 45-47
- Blamey R., Elston C., Pinder S., Ellis I. “When is a patient cured of breast cancer?”// J. Pathol.-2000.-Vol.-190.- p.44
- “Screening for Breast Cancer in England: Past and Future”, NHSBSP Publication No 61, February 2006, // www.cancerscreening.nhs.uk
- Yahara T., Koga T., Yoshida S., Nakagawa S., Deguchi H., Shirouzu K. “Relationship Between Microvessel Density and Thermographic Hot Areas in Breast Cancer” // Surgery Today (2003) 33:243–248
- Schneider B. P., Miller K. D. “Angiogenesis of Breast Cancer” // J. Clinical Oncology”, v23, n.8, March, p.1782-1790
- Соляник Г.И. Противоопухолевая антиангиогенная терапия: принципы, проблемы, перспективы // Онкология, т.8, №2, 2006, с. 206-208
- Weidner N., Semple J.P., Welch W.R., et al.: “Tumor angiogenesis and metastasis –correlation in invasive breast carcinoma” N. Engl. Journal Med. 1991, p. 324
- Weidner N., Folkman J., Pozza F., et al: “Tumor Angiogenesis: A New Significant and Independent Prognostic Indicator in Early –Stage Carcinoma.” Journal of the National Cancer Institute, vol. 84, № 24, December 16, 1992, . p. 1875-1887
- HeffelfingerS.C., YassinR., MillerM.A., Lower E. “Vascularity of Proliferative Breast Disease and Carcinoma in Situ Correlates with Histological Features” // Clinical Cancer Research, Vol. 2, Issue 11, p. 1873-1878
- Cao Y., Paner G. P., Kahn L.B., Rajan P.B. “Noninvasive Carcinoma of the Breast Angiogenesis and Cell Proliferation” Arch. Pathol. Lab. Med.—Vol. 128, August 2004 p.893-896
- Jean-Marc Guinebretiere “Angiogenesis and Risk of Breast Cancer in Women With Fibrocystic Disease” //Journal of the National Cancer Institute, Vol. 86, No.8, April 20, 1994, p.635-636
- Page D.L., Jensen R.A., Simpson J., Dupont W.D. “ Historical and Epidemiologic Background of Human Premalignant Breast Disease” Journal of Mammary Gland Biology and Neoplasia, vol. 5, №4, 2000, p.341-349
- Shapiro S. “Evidence on screening for breast cancer from a randomized trial”// Cancer, 1977, v. 39, p.2772-2782
- Frisell J., Glas U., Hellstrom L., et al “Randomized mammographic screening for breast cancer in Stockholm” // Breast Cancer Res Treat 8:45-54, 1986
- Frisell J., Eklund G., Hellstrom L., et al “Analysis of interval breast carcinomas in a randomized screening trial in Stockholm” // Breast Cancer Res Treat 9:219-225, 1987
- Tabar L., Fagerberg G., Duffy S.W., et al “Update of the Swedish two-county program of mammographic screening for breast cancer” // Radiol. Clin. North Am. 30:187-210, 1992



