Анемия – одно из наиболее частых симптомов, сопровождающих развитие злокачественных опухолевых процессов. При онкологических заболеваниях анемия является независимым фактором неблагоприятного прогноза выживаемости больных [1, 2].
Анемия присутствует у 40% больных немиелоидными злокачественными опухолями: легкая степень – в 30%, умеренная – в 9% и тяжелая – в 1% случаев. Общая частота анемии во время противоопухолевого лечения (химиотерапии или лучевой терапии) составляет 54% (легкая форма – 39%, умеренная – 14%, тяжелая – 1%). Частота ее выше у больных раком легкого (71%) или злокачественными опухолями женской репродуктивной системы (65%) и возрастает с увеличением количества курсов химиотерапии [3]
Причины развития анемии при злокачественных опухолях могут быть разными и связаны как с состоянием здоровья больного (гемоглобинопатии, талассемия, нарушение питания с дефицитом необходимых элементов, метаболические нарушения, болезнь почек), так и с самим опухолевым процессом (кровотечение, опухолевая инфильтрация костного мозга, гиперспленизм, анемия хронического заболевания) или противоопухолевым лечением (обширное облучение, гематологическая или почечная токсичность цитостатиков, индуцированный лекарственными препаратами гемолиз).
Согласно рекомендациям ESMO анемия определяется как снижение концентрации гемоглобина (Hb), количества эритроцитов или гематокрита ниже нормального уровня. В зависимости от концентрации Hb выделяют анемию легкой (уровень Hb 10–11,9 г/дл), умеренной (8,0–9,9 г/дл) и тяжелой степени (менее 8,0 г/дл) [4].
Степень тяжести анемии, являющейся следствием противоопухолевого лечения, определяется согласно основной шкале токсичности Национального института рака – CTCAEv3:
- степень 0 – Hb в пределах нормы;
- степень I – Hb ниже нижней границы нормы, но не ниже 10 г/дл;
- степень II – Hb выше 8 г/дл, но ниже 10 г/дл;
- степень III – Hb выше 6,5 г/дл, но ниже 8 г/дл;
- степень IV – Hb ниже 6,5 г/дл.
Химиотерапия является одной из наиболее частых причин развития или усугубления анемии у онкологических больных. Анализ частоты гемотрансфузий у 2719 пациентов, проведенный в Великобритании, показал, что на фоне химиотерапии в 38% случаев наблюдалось падение концентрации Hb ниже 11 г/дл и в 33% потребовалась по крайней мере однократная гемотрансфузия.
В настоящее время для коррекции анемии в онкологии широкое распространение получили стимуляторы эритропоэза или непосредственно в переводе с английского языка (erythropoiesis-stimulating agents – ESAS) эритропоэзстимулирующие агенты (ЭСА), клиническая эффективность которых доказана в многочисленных клинических исследованиях. Известно, что при анемии у онкологических больных наблюдается абсолютное или относительное снижение продукции эндогенного эритропоэтина, дефицит которого может быть компенсирован путем введения экзогенных стимулятов эритропоэза: эпоэтина-а, эпоэтина-в, дарбэпоэтина-а.
Первый опыт успешного применения ЭСА у больных с терминальной стадией заболеваний почек, находящихся на гемодиализе, показал, что гемотрансфузии являются не единственным методом коррекции анемии и что анемия обратима. Этот факт послужил толчком для организации подобных исследований в онкологии для больных с анемией, индуцированной цитостатиками. Первое же рандомизированное исследование продемонстрировало эффективность рекомбинантного человеческого эритропоэтина в качестве корректора анемии у онкологических больных, получающих химиотерапию. [5]
Результаты 3 крупных открытых нерандомизированных исследований [6–8] подтвердили этот вывод: было показано, что применение ЭСА приводит к повышению уровня Hb, снижению потребности в гемотрансфузиях и улучшению качества жизни больных даже в случаях неэффективной химиотерапии. Одним из наиболее важных результатов этих исследований явилось установление оптимального уровня Hb (12 г/дл), при котором достигается максимальное улучшение качества жизни. Именно этот уровень Hb (12 г/дл) признан оптимальным всеми комитетами по выработке клинических рекомендаций и до настоящего времени является целевым при лечении ЭСА.
Организованные в дальнейшем рандомизированные плацебо-контролируемые клинические испытания [9–17] и данные метаанализов [18–21] подтвердили эффективность ЭСА и показали в целом хорошую переносимость их в сочетании с химиотерапией. Наиболее грозным побочным эффектом, по данным всех исследований и крупного метаанализа [18], являлся повышенный риск тромбоэмболических осложнений, который возрастал пропорционально увеличению значения целевого уровня Hb, заданного в исследовании [18].
Однако в исследуемой популяции больных увеличение риска осложнений не сопровождалось увеличением смертности (относительный риск – HR 1,08; 95% доверительный интервал – 95% ДИ 0,99–1,18; 42 исследования, 8167 больных) [18]. Результаты ретроспективного анализа исследования об улучшении выживаемости больных, получавших эпоэтин-а.Это послужило основанием для организации проспективных исследований, которые пытались обосновать гипотезу улучшения выживаемости путем достижения в процессе лечения целевого уровня Hb, превышающего оптимальный, и расширения показаний для использования ЭСА, изучая их эффективность в качестве средства профилактики анемии, а также у онкологических больных, не получающих химиотерапию. Опубликованные результаты подобных клинических исследований [22–31] и метаанализа [32] свидетельствовали о негативном влиянии ЭСА на продолжительность жизни больных и/или на эффективность контроля роста опухоли.
Таблица 1. Рандомизированные, двойные слепые плацебо-контролируемые исследования по оценке эффективности дарбэпоэтина-a при анемии, индуцированной цитостатиками (n=2112)
| Автор | Тип опухоли, фаза исследования | N | Продолжительность терапии, нед |
МНЛН | МВН, мес | Плацебо | Дарбэпоэтин-α | ||
|---|---|---|---|---|---|---|---|---|---|
| режим | n | доза, мкг/кг | n | ||||||
| D.Kotasek, 2003 г. | Солидные II | 249 | 12 | нет | 2,8 | 1 раз в 3 нед | 51 | 4,5 | 32 |
| 6,75 | 17 | ||||||||
| 9 | 46 | ||||||||
| 12 | 28 | ||||||||
| 13,5 | 35 | ||||||||
| 15 | 40 | ||||||||
| D.Kotasek, 2002 г. | Солидные II | 156 | 12 | нет | 2,8 | 1 раз в 4 нед | 31 | 9 | 31 |
| 12 | 31 | ||||||||
| 15 | 33 | ||||||||
| 18 | 30 | ||||||||
| M.Hedenus, 2002 г. | ЛФП II | 66 | 12 | нет | 3,5 | 1 раз в неделю | 11 | 1 | 11 |
| 2,25 | 22 | ||||||||
| 4,5 | 22 | ||||||||
| J.Vansteenkiste, 2002 г. | Рак легкого III | 314 | 12 | да | 7,5 | 1 раз в 1 нед | 158 | 2,25 | 156 |
| M.Hedenus, 2003 г. | ЛФП III | 344 | 12 | да | 29,4 | 1 раз в 1 нед | 170 | 2,25 | 174 |
| K.Taylor, 2005 г. | Немиелоидные III | 386 | 15 | нет | 4,2 | 1 раз в 3 нед | 193 | 300/3 нед | 193 |
| R.Pirker,2007 г. | МРЛ III | 597 | 18 | да | 8,6 | 1 раз в x4 нед, затем 1 раз в 3 нед | 298 | 300/нед x 4 нед, затем 300/3 нед | 299 |
Примечание. ЛФП – лимфопролиферативные злокачественные опухоли, МНЛН – многолетнее наблюдение, МВН – медиана времени наблюдения.
1. BEST [24] – профилактика анемии у больных диссеминированным раком молочной железы без анемии, получающих химиотерапию первой линии. Рандомизированное исследование по сравнению эффективности эпоэтина-а и плацебо, включившее 939 пациенток с концентрацией Hb не более 13 г/дл. Целевой уровень Hb – 12–14 г/дл. Получено снижение годичной выживаемости пациенток, получавших эритропоэтин (70% против 76%; HR 1,37; p=0,01), при отсутствии различий в частоте достижения объективного эффекта и времени до прогрессирования болезни. Наибольшее число смертельных исходов зарегистрировано в первые 4 мес лечения за счет более высокой частоты раннего прогрессирования опухоли (6% против 3%) и тромботических и сосудистых осложнений (1% против 0,2%) у больных из группы эритропоэтина. Однако ретроспективный анализ данных независимыми экспертами показал, что группа больных, получавших эпоэтин-а, была прогностически гораздо менее благоприятной, чем группа плацебо (более пожилой возраст, более тяжелое общее состояние и большая распространенность болезни на момент включения, большее число факторов риска развития тромбоэмболических и сосудистых осложнений).
2. ENHANCE [22] – профилактика анемии у больных раком области головы и шеи без анемии (n=351), получающих лучевую терапию. Рандомизированное исследование по сравнению эффективности эпоэтина-а и плацебо. Целевой уровень Hb – 14,5–15 г/дл. Отмечено снижение выживаемости без прогрессирования у больных, получавших эритропоэтин (HR 1,39). Однако этот вывод был сделан при анализе всей популяции включенных больных и в подгруппе пациентов гипофарингеальным раком: при сравнительном анализе пациентов, оцененных согласно протоколу, разницы не отмечено (p=0,11). Помимо того, при отдельном рассмотрении подгруппы больных, радикально прооперированных и получавших лучевую терапию в адъювантном режиме, различий во времени до прогрессирования болезни не выявлено (р=0,9). В подгруппе больных, которым были выполнены паллиативные операции, а также в подгруппе больных, которым операции не выполнялись, выявлено достоверное (р=0,001 и p=0,006 соответственно) уменьшение выживаемости без прогрессирования у больных, получавших эпоэтин. Исследовате- ли предположили, что данный феномен ускорения роста опухоли при стимуляции эпоэтином-а связан с активацией рецепторов эритропоэтина, расположенных на опухолевых клетках. В связи с этим авторы ретроспективно оценили экспрессию рецепторов к эритропоэтину в опухоли у 154 больных.
Экспрессия эритропоэтиновых рецепторов выявлена в 104 (68%) случаях и не определялась иммуногистохимически в 50 (32%) случаях. При рецепторположительных
опухолях получено статистически значимое уменьшение времени до прогрессирования болезни у больных, получавших эпоэтин-в (р=0,003). При рецепторотрицательных опухолях достоверных различий не выявлено (р=0,86).
3. В конце 2006 г. были опубликованы результаты рандомизированного исследования DAHANCA-10 [26], в котором изучали эффективность дарбэпоэтина-а у больных плоскоклеточным раком головы и шеи с исходным уровнем Hb не более 14,5 г/дл, получавших лучевую терапию. Целевой уровень Hb – 14,0–15,5 г/дл. Исследование прекратили после промежуточного анализа результатов лече- ния 484 пациентов. Частота местных рецидивов в течение 3 лет была на 10% выше у больных, получавших дарбэпоэтин-а, разница оказалась статистически достоверной (p<0,01), продолжительность жизни больных этой подгруппы также имела тенденцию к ухудшению по сравнению с контролем (p=0,08).
4. EPO-CAN 20 [25] – рандомизированное сравнительное исследование эффективности эпоэтина-а и плацебо у 70 больных немелкоклеточным раком легкого, не получавших специфического противоопухолевого лечения, при исходном уровне Hb менее 12,1 г/дл. Целевой уровень Hb – 12–14 г/дл. Медиана продолжительности жизни оказалась выше у больных, получавших плацебо (129 дней против 63 дней; HR 1,84; p=0,04).
5. AMGEN 20010103 [22] – рандомизированное сравни- тельное исследование эффективности дарбэпоэтина-а и плацебо при лечении анемии у онкологических больных, не получавших специфическую противоопухолевую терапию. Не достигнута главная цель – снижение числа гемотрансфузий в группе дарбэпоэтина-а, кроме того, отмечено повышение летальности в группе больных, получавших дарбэпоэтин-а.
Столь неожиданные выводы вызвали широкую дискуссию в научных кругах и стимулировали организацию метаанализов материалов исследований по изучению ЭСА в онкологии.
В 2009 г. J.Cochrane опубликованы результаты индивидуальных данных больных–участников исследований по изучению ЭСА [34]. Основной целью статистического анализа, проведенного независимыми экспертами-статистиками, являлась оценка смертности во время активного периода исследования и общей выживаемости больных в течение максимально доступного периода наблюдения.
В результате критического отбора в метаанализ было включено 53 рандомизированных контролируемых исследования с общим числом больных 13 933. В 38 (72%) исследованиях больные получали химиотерапию, в 3 (6%) – лучевую терапию, в 5 (9%) – химиолучевое лечение. Пациентам 5 (9%) исследований противоопухолевое лечение не проводили, в 2 исследованиях химиотерапию получали менее 70% включенных больных.
Наиболее частыми видами злокачественных опухолей были рак молочной железы (у 4302 из 13 933 больных, т.е. 31%) и рак легкого (у 22%). Исходная концентрация Hb составила в среднем 10,6 г/дл у больных, получавших ЭСА, и 10,8 г/дл у больных контрольной группы. Продолжительность лечения ЭСА варьировала от 8 нед до 52 нед, в 20 исследованиях она зависела от продолжительности химиотерапии. Доза эпоэтина-а варьировала от 21 000 МЕ/нед до 63 000 МЕ/нед, дарбэпоэтина-а – от 100 мкг/нед до 157,5 мкг/нед. Средняя концентрация Hb, достигнутая в течение первых 4 мес активного периода исследования у больных, получавших ЭСА, составила в 2 исследованиях 15,0 г/дл и более, в 4 – 14 г/дл и более, в остальных исследованиях (12 245 больных, т.е. 88% от 13 933) – менее 14,0 г/дл.
В течение активного периода исследования умерли 1530 больных: 865 (11,3%) из 7634, получавших ЭСА, и 665 (10,6%) из 6299 из группы контроля. Разница составила 0,7%. В 4 исследованиях смертельных исходов за этот период не зафиксировано. Среди больных, получавших химиотерапию, частота смертей в активный период исследования составила 10,7% (605/5676) при лечении ЭСА и 10,3% (490/4765) в контрольной группе. Разница между показателями составила 0,4%. В 2 исследованиях смертельных исходов в этот период не зарегистрировано.
Результаты анализа данных 53 исследований на основе отношения рисков показали, что ЭСА повышали смертность в течение активного периода исследования на 17% (комбинированный HR 1,17; 95% ДИ 1,06–1,30; p=0,003) и ухудшали общую выживаемость больных (комбинированный HR 1,06; 95% ДИ 1,00–1,12; p=0,046). Из 10 441 больного, получившего химиотерапию в рамках 38 исследований, 5676 после рандомизации были назначены эритропоэтины, 4765 пациентов вошли в группу контроля. При сравнительном анализе данных подгрупп не выявлено статистически достоверных различий как в отношении смертности в течение активного периода исследования (комбинированный HR 1,10; 95% ДИ 0,98–1,24; p=0,12), так и в отношении общей выживаемости больных (комбинированный HR 1,04; 95% ДИ 0,97–1,11; p=0,263). Исключение из анализа исследования BEST привело к снижению отношения рисков смерти в течение активного периода исследования для больных, получавших химиотерапию, до 1,03 (95% ДИ 0,90–1,18).
Всего за время наблюдения из 13 933 больных умерли 4993: 34,6% в группе ЭСА и 37,3% в контрольной группе. Из числа больных, получавших химиотерапию, умерли 33,3% пациентов, получавших ЭСА, и 35,0% больных из контрольной группы.
Аналогичный метаанализ 52 рандомизированных исследований с общим числом больных 12 006 был проведен в Канаде [35]. Согласно полученным данным, применение ЭСА привело к клинически выраженному улучшению качества жизни онкологических больных и снижению частоты гемотрансфузий, но повышало риск развития тромбоэмболий (HR 1,69; 95% ДИ 1,27–2,24) и серьезных побочных эффектов (HR 1,16; 95% ДИ 1,08–1,25). Частота летальных исходов также была достоверно выше (разница составила 2%) в группе больных, получавших ЭСА (HR 1,15; 95% ДИ 1,03–1,29), в том числе и при целевом уровне Hb 12 г/дл и менее (HR 1,15; 95% ДИ 0,94–1,40).
Ряд авторов придерживаются противоположного мнения. Так, P.Gascon [36] проанализировал данные 36 рандомизированных исследований с точки зрения соблюдения показаний к назначению ЭСА, используя статистическую модель J.Сochrane [18]. Результат анализа показал, что назначение ЭСА с целью уменьшения потребности в гемотрансфузиях больным не повышает риск смерти, повышение смертности наблюдается только при анализе исследований, изучающих ЭСА по новым показаниям.
Данную точку зрения поддерживают M.Nowrousian и соавт. [37] и B.Melosky [38].
В своей статье M.Nowrousian и соавт. обращают внимание на тот факт, что, согласно результатам экспериментов на животных, ЭСА повышают эффективность лучевой и химиотерапии. Ни в одном исследовании не отмечено стимуляции опухолевого роста. Исследования, показавшие возможность стимуляции опухолевого роста, проведены на клеточных линиях с использованием высоких концентраций эритропоэтина, намного превосходящих терапевтические. Существуют данные о синергизме между ЭСА и цитостатиками в отношении подавления роста опухоли. Что касается исследования DAHANCA 10, то действительно показано, что рецепторы к эритропоэтину могут находиться на опухолевых клетках, однако чаще всего они не функциональны, т.е. не могут связываться с эритропоэтином или запускать передачу сигнала. Автор обращает внимание на тот факт, что антитела, используемые для идентификации рецепторов к эритропоэтину (С-20 поликлоновые антитела), не являются узко специфичными и могут связываться с рядом белков, предопределяющих неблагоприятное течение опухолевого процесса. Эти антитела не могут использоваться для определения экспрессии рецепторов к эритропоэтину на поверхности опухолевых клеток, так как они связываются только с внутриклеточным, не взаимодействующим с эритропоэтином доменом рецептора.
Критически анализируя исследования, показавшие отрицательное значение ЭСА для больных солидными опухолями, B.Melosky и M.Nowrousian и соавт. отмечают, что большинство из них страдает методологическими погрешностями и ни одно не было проведено в рамках стандартных рекомендаций и показаний к применению ЭСА.
Аналогичные критические замечания высказаны и в статье H.Ludwig и соавт. [39].
Из 8 регистрационных исследований по определению показаний к назначению ЭСА, проведенных в США, 4 включали больных, получавших химиотерапию [24, 27, 29, 30], 2 – лучевую терапию [23, 26], которая не включена в официальные показания к применению ЭСА. При этом целевой уровень Hb во всех 6 исследованиях значительно превышал рекомендуемый. Два исследования включали пациентов, не получавших ни лучевую, ни химиотерапию по поводу распространенного злокачественного опухолевого заболевания [22, 25], что также выходит за рамки официальных рекомендаций.
Таким образом, данные о негативном влиянии ЭСА на продолжительность жизни больных и эффективность контроля роста опухоли получены в исследованиях, изучавших их вне рамок официальных показаний к применению.
H.Ludwig и соавт. [39] провели первый анализ совокупных индивидуальных данных онкологических больных – участников всех рандомизированных плацебо-контролируемых клинических исследований по изучению дарбэпоэтина-а с точки зрения современных показаний к назначению стимуляторов эритропоэза при анемии, вызванной цитостатиками. Анализ индивидуальных данных пациентов дает возможность стандартизировать главную цель исследования и уменьшить различия между исследованиями, выявить исходные параметры пациентов, которые могли бы предсказать конечный результат лечения. Помимо того, анализ большого числа больных позволяет выявить даже незначительные различия между группами, которые невозможно определить при анализе каждого, отдельно взятого исследования.
Все 6 исследований, включенных в анализ, представляли собой завершенные рандомизированные слепые плацебоконтролируемые исследования, включавшие больных немиелоидными злокачественными опухолями, получавших химиотерапию. За исключением больных мелкоклеточным раком легкого, все пациенты, включенные в исследования, получили не менее 1 курса химиотерапии, имели исходный уровень Hb не более 11 г/дл, перспективы для дальнейшей химиотерапии и/или лучевой терапии. При мелкоклеточном раке легкого [17] допускались значения исходного уровня Hb в пределах 9–13 г/дл, введение первой дозы цитостатиков совпадало с введением первой дозы дарбэпоэтина-а. Введение дарбэпоэтина-а прерывали при значении Hb 14 г/дл и более для женщин и 15 г/дл и более для мужчин; хотя в исследованиях, опубликованных R.Pirker [17] и K.Taylor [12], введение дарбэпоэтина-а прерывали вне зависимости от пола при достижении концентрации Hb более 14 г/дл и 13 г/дл соответственно.
Авторами проведена оценка влияния дарбэпоэтина-а в сравнении с плацебо на безопасность лечения и потребность в гемотрансфузиях, а также взаимосвязи гемотрансфузий, исходной и достигнутой в процессе лечения концентрации Hb и безопасности терапии.
Главными параметрами безопасности, оценка которых проведена в ходе исследования, являлись общая выживаемость, выживаемость без прогрессирования, прогрессирование болезни в период лечения и в период длительного наблюдения, а также число смертей и число побочных явлений, определяемых на основе их известной или гипотетической связи с безопасностью лечения, связанных с препаратом.
Поиск летальных исходов осуществлялся 1) среди причин прекращения введения исследуемого препарата или исследования, 2) по отчетам о фатальных побочных явлениях, 3) по формам длительного наблюдения за больными. За исключением мелкоклеточного рака легкого, сбор данных о дате прогрессирования болезни протоколами исследования не предусматривался. В связи с этим прогрессирование болезни устанавливалось в следующих случаях: 1) если причиной прекращения химиотерапии или исследуемого препарата явилось прогрессирование болезни; 2) если прогрессирование болезни зафиксировано на момент окончания исследования; 3) если прогрес- сирование болезни было зарегистрировано в форме длительного наблюдения за больным. Если же прогрессирование болезни не было зафиксировано, анализировалась динамика болезни на момент окончания исследования и далее в период наблюдения за больным. Определение времени до прогрессирования процесса базировалось на наиболее ранней дате выявления прогрессирования болезни; период ВПБ вычислялся до даты прогрессирования болезни или до даты смерти пациента, если смерть наступила раньше.
Выборка побочных явлений осуществлялась вне зависимости от их тяжести и взаимосвязи с исследуемым препаратом. Учитывался каждый случай гемотрансфузии начиная с 5-й недели и до окончания периода лечения.
Большинство больных были белой расы. Средний возраст был одинаковым в обеих группах; женщин было больше в группе дарбэпоэтина-а. В группе плацебо по сравнению с группой дарбэпоэтина-а был выше процент больных, получавших химиотерапию, включавшую производные платины (табл. 2).
Таблица 2. Характеристика больных
| Характеристика | Дарбэпоэтин-a (n=1200) |
Плацебо (n=912) |
Общее количество (n=2112) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | ||||
| Пол | |||||||||
| мужской | 596 | 49,7 | 493 | 54,1 | 1089 | 51,6 | |||
| женский | 604 | 50,3 | 419 | 45,9 | 1023 | 48,4 | |||
| Раса | |||||||||
| европеоидная | 1129 | 94,1 | 866 | 95 | 1995 | 94,5 | |||
| негроидная | 30 | 2,5 | 22 | 2,4 | 52 | 2,5 | |||
| другие | 41 | 3,4 | 24 | 2,4 | 65 | 3,1 | |||
| Возраст, годы | |||||||||
| медиана | 61,9 | 62,0 | 61,9 | ||||||
| стандартное отклонение | 11,6 | 10,7 | 11,3 | ||||||
| моложе 65 | 659 | 54,9 | 522 | 57,2 | 1181 | 55,69 | |||
| 65 лет и старше | 541 | 45,1 | 390 | 42,7 | 931 | 44,1 | |||
| Платиносодержащая химиотерапия | 656 | 54,7 | 571 | 62,6 | 1127 | 58,1 | |||
| Тип опухоли | |||||||||
| легкое | 532 | 44 | 505 | 55 | 1037 | 49 | |||
| гематология | 255 | 21 | 217 | 24 | 427 | 22 | |||
| молочная железа | 144 | 12 | 62 | 7 | 206 | 10 | |||
| гастроинтестинальная | 106 | 9 | 56 | 6 | 162 | 8 | |||
| гинекологическая | 81 | 7 | 31 | 3 | 112 | 5 | |||
| мочеполовая | 41 | 3 | 10 | 1 | 51 | 2 | |||
| другие | 41 | 3 | 31 | 3 | 72 | 3 | |||
| Стадия заболевания | |||||||||
| II и ниже | 128 | 10,7 | 99 | 10,9 | 227 | 10,7 | |||
| III и выше | 1037 | 86,4 | 782 | 85,7 | 1819 | 86,1 | |||
| другие | 23 | 1,9 | 17 | 1,9 | 40 | 1,9 | |||
| неизвестно | 12 | 1,0 | 14 | 1,5 | 26 | 1,2 | |||
| ECOG | |||||||||
| 0 | 282 | 23,5 | 179 | 19,6 | 461 | 21,8 | |||
| 1 | 648 | 54,0 | 495 | 54,3 | 1143 | 54,1 | |||
| 2 | 162 | 13,5 | 150 | 16,4 | 312 | 14,8 | |||
| 3 | 10 | 0,8 | 7 | 0,8 | 17 | 0,8 | |||
| неизвестно | 98 | 8,2 | 81 | 8,9 | 179 | 8,5 | |||
| Исходный уровень Hb, г/дл | 1169 | 876 | 2045 | ||||||
| медиана | 10,5 | 10,5 | 10,5 | ||||||
| стандартное отклонение | 1,4 | 1,4 | 1,4 | ||||||
| Исходный уровень эндогенного эритропоэтина, МЕ/мл | 1137 | 859 | 1996 | ||||||
| медиана | 76,3 | 84,1 | 79,7 | ||||||
| стандартное отклонение | 134,5 | 209,5 | 170,9 | ||||||
Наиболее частыми видами злокачественных опухолей были рак легкого и гемобластозы. Данные типы опухолей диагностированы у 65% больных группы дарбэпоэтина-а и 79% больных группы плацебо. Большая часть больных имела распространенный процесс, определенный как III стадия и выше. Функциональный статус по шкале ECOG, исходная концентрация Hb и эритропоэтина представлены в табл. 2. Анализ выживаемости больных и прогрессирования болезни с учетом данных длительного наблюдения не выявил влияния дарбэпоэтина-а на эти показатели. Кривые общей выживаемости, выживаемости без прогрессирования и времени до прогрессирования болезни, построенные для больных, получивших дарбэпоэтин-а, и больных, получивших плацебо, практически полностью совпадали: для общей выживаемости HR составил 0,97 (95% ДИ 0,85–1,1), для выживаемости без прогрессирования HR составил 0,93 (95% ДИ 0,84–1,04), для времени до прогрессирования болезни – HR 0,92 (95% ДИ 0,82–1,03) (рис. 1).
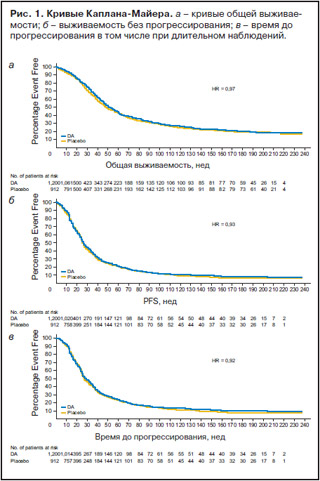
Побочные явления, зарегистрированные во время исследования, представлены в табл. 3.
Таблица 3. Побочные явления, зарегистрированные во время исследования
| Осложнение |
Дарбэпоэтин-α (n=1200) |
Плацебо (n=912) |
HR |
95% ДИ |
||
|---|---|---|---|---|---|---|
| n |
% |
n | % | |||
| Сердечно-сосудистые и тромбоэмболические | 192 | 16,0 | 127 | 13,9 | 1,26 | 1,00-1,59 |
| Аритмия | 57 | 4,7 | 43 | 4,7 | 1,15 | 0,77-1,72 |
| Цереброваскулярные | 20 | 1,7 | 18 | 2,0 | 1,05 | 0,55–1,98 |
| Застойная сердечная недостаточность | 20 | 1,7 | 23 | 2,5 | 0,81 | 0,44–1,48 |
| ИМ или ИБС | 21 | 1,8 | 13 | 1,4 | 1,34 | 0,66–2,71 |
| Эмболия или тромбоз | 96 | 8,0 | 46 | 5,0 | 1,57 | 1,10–2,26 |
| Инсульт | 7 | 0,6 | 11 | 1,2 | 0,62 | 0,24–1,60 |
| Гипертензия | 47 | 3,9 | 31 | 3,4 | 1,33 | 0,84–2,10 |
Примечание. ИМ – инфаркт миокарда, ИБС – ишемическая болезнь сердца.
В период проведения исследования умерли 110 (9,2%) больных в группе дарбэпоэтина-а и 92 (10,1%) в группе плацебо. Отношение рисков смерти свидетельствует об отсутствии достоверных различий между двумя группами (HR 1,11; 95% ДИ 0,84–1,47).
Риск развития сердечно-сосудистых и тромбоэмболических осложнений был выше при применении дарбэпоэтина-а (HR 1,26; 95% ДИ 1,0–1,59) в первую очередь за счет более высокой частоты тромбоэмболических осложнений в этой группе (8% по сравнению с 5% в группе плацебо; HR 1,52; 95% ДИ 1,10–2,26). Частота развития инфаркта миокарда и болезни коронарных артерий также была выше при лечении дарбэпоэтином-а, однако процент больных был невелик, а 95% ДИ для HR был широким. Частота таких видов сердечно-сосудистых осложнений, как аритмии, цереброваскулярные нарушения и застойная сердечная недостаточность, была одинаковой в обеих группах.
Анализ влияния исходного уровня Hb на параметры безопасности показал, что независимо от исходной концентрации Hb дарбэпоэтин-а не увеличивал смертность и не влиял на выживаемость без прогрессирования (рис 2, а, б). Однако имелась тенденция к взаимосвязи между риском развития тромбоэмболических осложнений, ассоциированных с дарбэпоэтином-а, и уровнем исходного Hb (рис. 2, в).
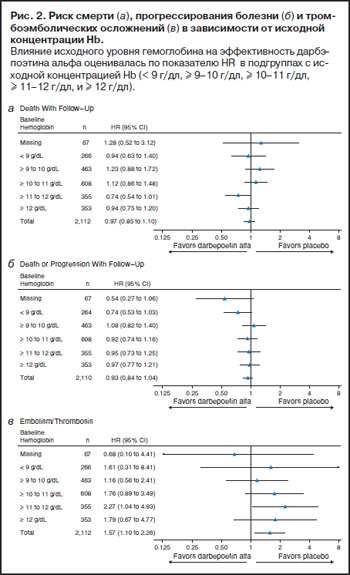
Не получено увеличения смертности или стимуляции опухолевого прогрессирования у пациентов, уровень Hb у которых в процессе лечения превысил 12 г/дл и 13 г/дл, а также у больных с повышением концентрации Hb на фоне дарбэпоэтина-а не менее 1 г/дл в течение первых 14 дней или не менее 2 г/дл в течение 28 дней без гемотрансфузий. Авторы предполагают, что способность к быстрому восстановлению уровня Hb может быть признаком более благоприятного биологического прогноза. В этом случае негативные результаты, полученные в исследованиях с высоким целевым уровнем Hb, могут быть отнесены к больным, нечувствительным к ЭСА. Подобное предположение нуждается в дополнительном исследовании с учетом эффективности проводимой химиотерапии.
Поскольку помимо дарбэпоэтина-а концентрация Hb может быть повышена и с помощью гемотрансфузий, проведено изучение влияния трансфузий на уровень достигнутого Hb. Гемотрансфузии лишь незначительно увеличили долю больных, у которых уровень Hb был более 12 г/дл: с 35,8% до 37,8% при лечении дарбэпоэтином-а и с 13,8% до 15,8% при использовании плацебо. Процент больных, уровень Hb которых превысил 13 г/дл с помощью или без помощи гемотрансфузий, тоже отличался незначительно: 62,4% против 57,6% для дарбэпоэтина-а и 40,8% против 33,7% для плацебо. Анализ выживаемости больных в зависимости от максимально достигнутого уровня Hb показал, что общая выживаемость и выживаемость без прогрессирования лучше у больных, уровень Hb у которых был выше 12 г/дл и 13 г/дл, чем у пациентов, у которых концентрация Hb была ниже. Четкой взаимосвязи между риском развития эмболий/тромбозов и достижением концентрации Hb, превышающей 12 или 13 г/дл, не отмечено.
Исследовали также влияние трансфузий на частоту увеличения концентрации Hb. При отсутствии трансфузий доля больных, повышение концентрации Hb у которых составило более 1 г/дл в течение 14 дней или более 2 г/дл в течение 28 дней, была равна 68,8% для дарбэпоэтина-а и 52,3% для плацебо или 39,1% для дарбэпоэтина-а и 19,2% для плацебо соответственно. Когда же в анализ были включены только пациенты, получившие трансфузии, процент больных, концентрация Hb у которых достигла указанного выше уровня, оказался одинаковым в обеих лечебных группах: 86,7% для дарбэпоэтина-а, 87,5% для плацебо или 77,6% для дарбэпоэтина-а, 75,3% для плацебо соответственно. Гемотрансфузии как единственная причина достижения желаемого уровня Hb ассоциировались с увеличением риска смерти и прогрессирования болезни (рис. 3, б, в). При анализе подгруппы больных, не получавших гемотрансфузии, подобной взаимосвязи не обнаружено (рис. 3, б, в). Не установлено четкой взаимосвязи между риском развития эмболий/тромбозов и частотой повышения концентрации Hb в зависимости от наличия или отсутствия гемотрансфузий (см. рис. 3).
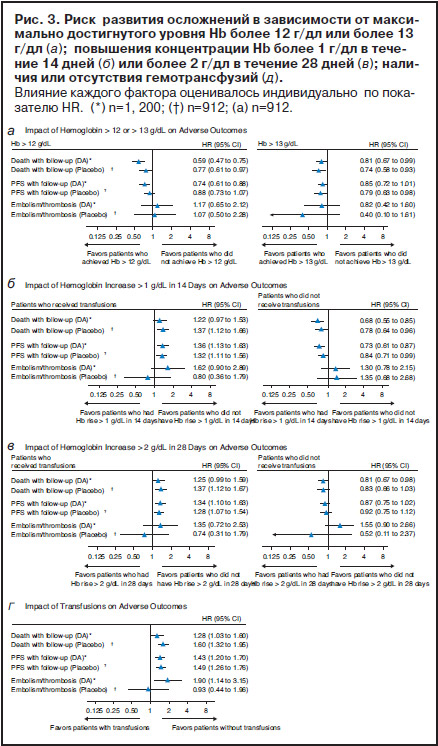
Наличие гемотрансфузий ассоциировалось с более высоким риском смерти и прогрессирования болезни как у пациентов, получавших дарбэпоэтин-а, так и у пациентов, получавших плацебо, а также с более высоким риском развития эмболий/тромбозов в группе дарбэпоэтина-а (рис. 3, г).
Известно, что потребность в гемотрансфузиях является признаком более тяжелого общего состояния пациента и менее благоприятного прогноза заболевания, что и могло, по мнению авторов, явиться причиной полученного негативного результата. Необходимы дальнейшие исследования в этой области.
По сравнению с плацебо дарбэпоэтин-а снижал необходимость гемотрансфузий, начиная с 5-й недели лечения и до его окончания, независимо от исходного уровня Hb (рис. 3, а). Как и ожидалось, больные (19%) с исходным уровнем Hb 10–11 г/дл нуждались в гемотрансфузиях в 2 раза реже, чем больные (41%) с исходным уровнем Hb менее 9 г/дл.
Таким образом, H.Ludwig и соавт. не выявили повышения смертности или стимуляции опухолевого процесса при назначении дарбэпоэтина-а на фоне химиотерапии. В ряде исследований [18–21] и в исследовании J.Cochrane [34] также не выявлено четкого влияния на смертность или прогрессирование опухолевого процесса у больных, получавших химиотерапию.
Показано, что у онкологических больных повышен риск развития тромбозов [40, 41]. В анализе, проведенном H.Ludwig и соавт., дарбэпоэтин-а повышал абсолютный риск развития тромбоэмболических осложнений с 5% до 8% (57% повышение HR), что значительно ниже данных, полученных в 2 других метаанализах, в которых увеличение абсолютного риска развития тромбозов составило 67% и 68% [18, 19]. Повышенный риск развития тромбозов и связанных с ними осложнений может объяснить повышение смертности на фоне назначения ЭСА, отмеченное в некоторых исследованиях [24, 25–29]. Однако этот факт не повлиял на общую выживаемость больных. Возможно, какие-то дополнительные, неизученные факторы привели к негативным результатам, полученным в этих исследованиях.
Представленный метаанализ подтвердил способность ЭСА снижать потребность в гемотрансфузиях. В целом, у больных, получавших дарбэпоэтин-а, HR гемотрансфузий был на 54% ниже, чем в контрольной группе. Абсолютный риск зависел от исходного уровня Hb: при исходном уровне Hb, равном 9–10 г/дл, HR составил 0,5, при 12 г/дл и более – 0,32. Аналогичные результаты получены ранее в 2 других исследованиях [18, 42].
Таким образом, существует много исследований, посвященных изучению эффективности ЭСА при анемии, индуцированной цитостатиками, в которых не зарегистрировано негативное влияние на продолжительность жизни или течение опухолевого процесса и было показано улучшение общего состояния пациентов и снижение потребности в гемотрансфузиях. Еще одним доказательством являются результаты метаанализа H.Ludwig и соавт. Авторы понимают, что полученные данные не могут быть экстраполированы на всю популяцию онкологических больных и не могут отрицать негативные результаты других исследований. Но недостаточно ясное влияние стимуляторов эритропоэза на смертность больных и прогрессирование опухоли показывают, что необходима организация специальных исследований в этом направлении с учетом эффективности химиотерапии и стратификации сравниваемых групп пациентов в соответствии с факторами прогноза течения заболевания и риска развития тромботических осложнений.
В настоящее время при назначении стимуляторов эритропоэза онкологическим больным необходимо руководствоваться рекомендациями ESMO [4]: назначение ЭСА показано для лечения симптомной анемии, индуцированной химиотерапией у взрослых пациентов, страдающих немиелоидными злокачественными опухолями. Целью назначения является предупреждение гемотрансфузий, связанных с ними осложнений и возможность улучшения качества жизни за счет повышения уровня Hb.
1. Назначение ЭСА показано больным, получающим химиотерапию, при уровне Hb менее 10 г/дл в целях повышения его концентрации не более 12 г/дл или предупреждения дальнейшего его снижения.
2. Больным, получающим химиотерапию, уровень Hb которых составляет 10–12 г/дл, ЭСА могут быть назначены при наличии симптомов анемии или для предупреждения дальнейшего снижения концентрации Hb. Однако это выходит за рамки инструкций по использованию ЭСА.
3. Пациентам, не получающим химиотерапию, ЭСА не показаны ввиду возможного повышения риска смерти.
4. Больным, получающим лечение с целью излечения, ЭСА должны назначаться с осторожностью.
5. При повышении концентрации Hb по крайней мере на 1 г/дл по сравнению с исходной после 4 нед применения ЭСА вводимая доза может быть оставлена такой же или редуцирована на 25–50%.
6. При повышении концентрации Hb менее чем на 1 г/дл по сравнению с исходной после 4 нед применения ЭСА вводимая доза должна быть увеличена. Если после 4 нед применения ЭСА уровень Hb повышается не менее чем на 1 г/дл, вводимая доза может быть оставлена такой же или редуцирована на 25–50%.
7. В случае эффективного лечения ЭСА их применение должно быть прекращено через 4 нед после прекращения химиотерапии.
8. При повышении концентрации Hb менее чем на 1 г/дл по сравнению с исходным уровнем после 8–9 нед применения терапия ЭСА считается неэффективной и должна быть прекращена.
9. Если прирост Hb превышает 2 г/дл за 4 нед или уровень Hb превышает 12 г/дл, вводимая доза должна быть редуцирована на 25–50%.
10. Если уровень Hb превысил 12 г/дл, введение ЭСА необходимо прекратить, дождаться снижения уровня Hb ниже 12 г/дл, после чего следует возобновить введение ЭСА в дозе, сниженной на 25% по сравнению с предыдущей. Концентрация Hb не должна превышать 12 г/дл на фоне лечения ЭСА.
Автор: Н.С.Бесова
Отделение химиотерапии РОНЦ им. Н.Н.Блохина РАМН, Москва
Журнал "Современная онкология №4 2009 г."
Литература
- Albain K, Crowley J, LeBlanc M. Survival determinants in extensivestage non-small-cell lung cancer: the Southwest Oncology Group experience. J Clin Oncol 1991; 9: 1618–26.
- Wagner W, Hermann R, Hartlapp J. Prognostic value of hemoglobin concentrations in patients with advanced head and neck cancer treated with combined radio-chemotherapy and surgery. Strahlenthaer Onkol 2000; 176: 73–80.
- Ludwig H, Van Belle S, Barrett-Lee et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 2004; 40: 2293–306.
- Scrijvers D, Roila F and on behalf of the ESMO Guidelines Working Group. Erythropoiesis-stimulating agents in cancer patients: ESMO Recommendations for use. Ann Oncol 2009; 20(Suppl 4): iv159–iv161; doi:10.1093/annonc/mdp161.
- Henry D, Abels R. Recombinant human erythropoietin in the treatment of cancer and chemotherapy-induced anemia: results of double-blind and open-label follow-up studies. Semin Oncol. 1994; 21(suppl 3): 21–8.
- Demetri G, Kris M, Wade J et al. Quality-of life benefit in chemotherapy patients treated with epoetin alfa is independent of disease response or tumor type: Results from a prospective community oncology study—Procrit Study Group. J Clin Oncol 1998; 16: 3412–25.
- Glaspy J. The impact of epoetin alfa on quality of life during cancer chemotherapy: A fresh look at an old problem. Semin Hematol 1997; 34: 20–6.
- Gabrilove J, Cleeland C, Livingston R et al. Clinical evaluation of onceweekly dosing of epoetin alfa in chemotherapy patients: Improvements in hemoglobin and quality of life are similar to threetimes- weekly dosing. J Clin Oncol 2001; 19: 2875–82.
- Littlewood T, Bajetta E, Nortier J et al. Effects of epoetin alfa on hematologic parameters and quality of life in cancer patients receiving nonplatinum chemotherapy: Results of a randomized, double-blind, placebocontrolled trial. J Clin Oncol 2001; 19: 2865–74.
- Vansteenkiste J, Pirker R, Massuti B et al: Double-blind, placebocontrolled, randomized phase III trial of darbepoetin alfa in lung cancer patients receiving chemotherapy. J Natl Cancer Inst 94:1211- 1220, 2002
- Osterborg A, Brandberg Y, Molostova V et al. Randomized, doubleblind, placebo-controlled trial of recombinant human erythropoietin, epoetin beta, in hematologic malignancies. J Clin Oncol 2002; 20: 2486–94.
- Taylor K, Ganly P, Charu V et al. Randomized, double-blind, placebocontrolled study of darbepoetin alfa every 3 weeks for the treatment of chemotherapy-induced anemia. Blood 2005; 106: abstr 3556.
- Grote T, Yeilding A, Castillo R et al. Efficacy and safety analysis of epoetin alfa in patients with small-cell lung cancer: A randomized, doubleblind, placebo-controlled trial. J Clin Oncol 2005; 23: 9377–86.
- Witzig T, Silberstein P, Loprinzi C et al. Phase III, randomized, doubleblind study of epoetin alfa compared with placebo in anemic patients receiving chemotherapy. J Clin Oncol 2005; 23: 2606–617.
- Kotasek D, Steger G, Faught W et al. Darbepoetin alfa administered every 3 weeks alleviates anaemia in patients with solid tumours receiving chemotherapy: Results of a double-blind, placebocontrolled, randomised study. Eur J Cancer 2003; 39: 2026–34.
- Moebus V, Lueck H, Thomssen C et al. The impact of epoetin-alpha on anemia, red blood cell RBC) transfusions, and survival in breast cancer patients (pts) treated with dose-dense sequential chemotherapy: Mature results of an AGO phase III study (ETC trial). J Clin Oncol 2007; 25 (suppl); abstr 569.
- Pirker R, Ramlau R, Schuette W et al. A phase 3 randomized, double blind, placebocontrolled study of patients with previously untreated extensive-stage small cell lung cancer (SCLC) treated with platinum plus etoposide chemotherapy with or without darbepoetin alfa. J Thorac Oncol 2007; 2: abstr PD6-3-6.
- Bohlius J, Wilson J, Seidenfeld J et al. Recombinant human erythropoietins and cancer patients: Updated meta-analysis of 57 studies including 9353 patients. J Natl Cancer Inst 2006; 98: 708–14.
- Seidenfeld J, Pipe M, J et al. Comparative effectiveness of epoetin and darbepoetin for managing anemia in patients undergoing cancer treatment: Comparative Effectiveness Review no. 3. Prepared by Blue Cross and Blue Shield Association Evaluation Center Evidence-based Practice Center under contract no. 290-02-0026. Rockville, MD, Agency for Healthcare Research and Quality, 2006. www.effectivehealthcare. arhq.gov/reports/final.cfm
- Ross S, Allen I, Henry D et al. Clinical benefits and risks associated with epoetin and darbepoetin in patients with chemotherapy-induced anemia: A systematic review of the literature. Clin Ther 2006; 28: 801–31.
- Aapro M, Coiffier B, Dunst J et al. Effect of treatment with epoetin beta on short-term tumour progression and survival in anaemic patients with cancer: A meta-analysis. Br J Cancer 2006; 95: 1467–73.
- Smith R Jr, Aapro M, Ludwig H et al. Darbepoetin alpha for the treatment of anemia in patients with active cancer not receiving chemotherapy or radiotherapy: Results of a phase III, multicenter, randomized, double- blind, placebocontrolled study. J Clin Oncol 2008; 26: 1040–50.
- Henke M, Laszig R, Rube C et al. Erythropoietin to treat head and neck cancer patients with anaemia undergoing radiotherapy: Randomised, double-blind, placebo-controlled trial. Lancet 2003; 362: 1255–60.
- Leyland-Jones B, Semiglazov V, Pawlicki M et al Maintaining normal hemoglobin levels with epoetin alfa in mainly nonanemic patients with metastatic breast cancer receiving first-line chemotherapy: A survival study. J Clin Oncol 2005; 23: 5960–72.
- Wright J, Ung Y, Julian J et al. Randomized, double-blind, placebo-controlled trial of erythropoietin in non-small-cell lung cancer with diseaserelated anemia. J Clin Oncol 2007; 25: 1027–32.
- Overgaard J, Hoff C, Sand Hansen H et al. Randomized study of the importance of novel erythropoiesis stimulating protein (Aranesp®) for the effect of radiotherapy in patients with primary squamous cell carcinoma of the head and neck (HNSCC): The Danish Head and Neck Cancer Group (DAHANCA 10) randomized trial. Presented at 14th European Cancer Conference, Barcelona, Spain, September 23–27, 2007: abstr 6LB.
- Hedenus M, Adriansson M, San Miguel J et al: Efficacy and safety of darbepoetin alfa in anaemic patients with lymphoproliferative malignancies: randomized, double-blind, placebo-controlled study. Br J Haematol 2003; 122: 394–03.
- Amgen: Update to Hedenus et al (2003), Safety of Erythropoiesis- Stimulating Agents (ESAs) in Oncology: Background Information for Oncologic Drugs Advisory Committee. http://www.fda.gov/ohrms/dockets/ ac/07/briefing/2007-4301b2-01-01-Amgen.pdf
- Thomas G, Ali S, Hoebers FJ, et al. Phase trial to evaluate the efficacy of maintaining hemoglobin levels above 12.0 g/dL with erythropoietin above 10.0 g/dL without erythropoietin in anemic patients receiving concurrent radiation and cisplatin for cervical cancer. Gynecol Oncol 2008; 108: 317–25.
- Amgen: Amgen announces interim results Aranesp “PREPARE” study in breast cancer patients [Amgen press release]: November 30, 2007. Http:// wwwext.amgen.com/ media / media_pr_detail . jsp? year_2007 & releaseID_ 1083091
- Azria D, Zouhair A, Serre A et al. Anemia head and neck cancers. Bull Cancer 2005; 92: 445–51.
- Bennett C, Silver S, Djulbegovic B et al. Venous thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancerassociated anemia. JAMA 2008; 299: 914–24.
- Henke M, Mattern D, Pepe M et al. Do Erythropoietin Receptors on Cancer Cells Explain Unexpected Clinical Findings? J Clin Oncol 2006; 24: 4708–13.
- Bohlius J, Schmidlin K, Brillant C et al. Recombinant human erythropoiesisstimulating agents and mortality in patients with cancer: a metaanalysis of randomized trials. Lancet 2009; 373: 1532–42.
- Tonelli M, Reiman T, Reaume M et al. Benefits and harms of erythropoiesis- stimulating agents for anemia related to cancer: a meta-analysis. CMAJ 2009; 180(11).
- Gascon P. Safety Update on Erythropoiesis-Stimulating Agents:Trials Within and Outside the Accepted Indications. Oncologist 2008; 13(suppl 3): 4–10.
- Nowrousian M, Dunst J, Vaupel P. Erythropoiesis-Stimulating Agents: Favorable Safety Profile When Used as Indicated. Strahlenther Onkol 2008; 184: 121–36.
- Melosky B. Erythropoiesis-stimulating agents: benefits and risks in supportive care of cancer. Curr Oncol 2008; 15(Suppl 1): S10–5.
- Ludwig H, Crawford J, Cterborg F et al. Pooled Analysis of Individual Patient-Level Data From All Randomized, Double-Blind, Placebo-Controlled Trials of Darbepoetin Alfa in the Treatment of Patients With Chemotherapy-Induced Anemia. J Clin Oncol 2009; 27: s1–10.
- Heit J, Silverstein M, Mohr D et al: Risk factors for deep vein thrombosis and pulmonary embolism: A population-based case-control study. Arch Intern Med 2000; 160: 809–15.
- Blom J, Doggen C, Osanto S et al: Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA 2005; 293: 715–22.
- Lyman G, Glaspy J. Are there clinical benefits with early erythropoietic intervention for chemotherapy-induced anemia? A systematic review. Cancer 2006; 106: 223–3.



