Пожалуй, в большинстве случаев, когда речь идет об онкогематологии в немедицинской среде (а иногда и среди врачей), в первую очередь подразумеваются больные, страдающие лейкозами, а еще точнее, острыми лейкозами. Эта группа заболеваний характеризуется скоротечностью и, если не было начато адекватное лечение, быстро приводит к смерти. Данное обстоятельство породило мнение о неизлечимости острых лейкозов (впрочем, как и многих других онкологических заболеваний). Действительно, еще в обозримом прошлом диагноз «острый лейкоз» звучал как приговор. К сожалению, этот миф бытует и в настоящее время — эру новых лекарственных препаратов и высокотехнологичных методов исследования и терапии. Вероятно, другой причиной «известности» острого лейкоза является все более широкое применение трансплантации гемопоэтических стволовых клеток в рамках комплексного лечения этого заболевания. В этой статье мы попытались в общих чертах осветить достижения и проблемы терапии острых лейкозов.
Что же представляет собой острый лейкоз?
Становление лейкозологии связывают с именем немецкого морфолога Р. Вирхова. Впервые идея об опухолевой природе лейкозов была высказана в 1867 г. К. Славянским. В конце XIX — начале XX века морфологические исследования позволили выделить острые и хронические лейкозы. В нашей стране получил распространение термин «лейкоз», в то время как за рубежом используется понятие «лейкемия», что дословно переводится как белокровие. Оба термина являются синонимами и используются для обозначения острых и хронических лейкозов. Прежде всего острый лейкоз — это злокачественное заболевание кроветворной (гемопоэтической) ткани, возникающее в результате соматической мутации генетического материала в кроветворной клетке с последующим формированием опухолевого клона. При острых лейкозах морфологический субстрат болезни представлен бластными клетками. Быстрое деление (усиленная пролиферация) бластных клеток в костном мозге приводит к вытеснению нормального кроветворения. В результате в крови уменьшается число нормальных зрелых форменных элементов и появляются лейкемические клетки. В связи с угнетением выработки нормальных лейкоцитов у больного увеличивается вероятность развития инфекционных осложнений. Снижение числа тромбоцитов приводит к развитию геморрагического синдрома различной степени выраженности — от мелкоточечной геморрагической сыпи до кровотечений и кровоизлияний. Уменьшение количества эритроцитов, а следовательно, и уровня гемоглобина сопровождается проявлениями анемического синдрома (слабость, одышка, сердцебиение и др.). Наряду с инфильтрацией бластными клетками костного мозга может наблюдаться поражение органов и тканей за пределами костного мозга, например лимфатических узлов, селезенки, кожи, десен, яичек, центральной нервной системы и других внекостномозговых (экстрамедуллярных) локализаций.
Острые лейкозы по происхождению подразделяются на лимфобластные и миелоидные. Эти типы выделяют в зависимости от принадлежности популяции бластных (лейкемических) клеток к лимфоидному или миелоидному росткам кроветворения (см. рисунок). Лимфоидный росток представлен клетками 2 линий дифференцировки (созревания) — B- и T-линейной направленности, а миелоидный росток — 6 клеточными линиями, к финальным этапам созревания которых относят моноциты, сегментоядерные нейтрофилы, базофилы, эозинофилы, эритроциты и тромбоциты. В свою очередь опухолевые клетки по своей природе могут принадлежать каждой из перечисленных линий дифференцировки клеток лимфоидной или миелоидной природы.
- КОЕ-ГЭММ — колониеобразующая единица смешанная (гранулоциты, эритроциты, макрофаги, мегакариоциты);
- КОЕ-ГМ — колониеобразующая единица гранулоцитарно-макрофагальная;
- КОЕ-Э — колониеобразующая единица эритроцитов;
- КОЕ-Мег — колониеобразующая единица мегакариоцитов;
- КОЕ-Баз — колониеобразующая единица базофилов;
- КОЕ-Эоз — колониеобразующая единица эозинофилов;
- КОЕ-Г — колониеобразующая единица гранулоцитов;
- КОЕ-М — колониеобразующая единица макрофагов.
На принципе принадлежности бластных клеток определенному ростку кроветворения основывается современная классификация острых лейкозов. Помимо этого, классификация учитывает цитогенетические и молекулярно-биологические особенности опухолевых клеток, их морфологические свойства (наличие дисплазии), уровень дифференцировки, а также возможность развития болезни после применения химиопрепаратов или лучевой терапии по поводу предшествующих заболеваний (классификация ВОЗ 2001 г.) [1]. Острые лейкозы у взрослых являются довольно редкими заболеваниями. Ежегодная заболеваемость острыми лейкозами в мире составляет 4 случая на 100 тыс. населения. Острые лимфобластные лейкозы (ОЛЛ) наиболее часто диагностируются у детей (75% больных ОЛЛ моложе 6 лет). Частота ОЛЛ у взрослых составляет около 20% всех острых лейкозов. Острые миелоидные лейкозы (ОМЛ) (синоним: острые нелимфобластные лейкозы) составляют около 80% всех острых лейкозов у взрослых. Средний возраст больных ОМЛ 60—65 лет.
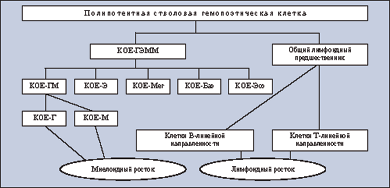
Схематическое представление нормального кроветворения
За последние 40 лет в терапии острых лейкозов были достигнуты значительные успехи. Первые препараты для лечения острых лейкозов (антагонисты фолиевой кислоты) были разработаны в 1948 г. В дальнейшем (1951—1954) был создан 6-меркаптопурин, а во второй половине 50-х годов XIX века — препараты из группы антагонистов пиримидина. В 60-х годах XX века было показано, что препарат с алкилирующим действием (циклофосфан) может быть использован для лечения острого лейкоза [2]. Тем не менее в начале 60-х годов до формирования основных принципов лечения острых лейкозов это заболевание являлось фатальным. Г.В. Осеченская в диссертации, посвященной клинике и терапии острых лейкозов, в 1961 г. указывает, что до 1 года доживают 28,2% больных, до 2 лет и более — лишь 1,3% [3]. В 1962 г. И.А. Кассирский и Г.А. Алексеев в книге «Клиническая гематология» писали о результатах лечения острого лейкоза: «Мы можем констатировать среди нашего материала лишь 2% больных, длительность жизни которых в связи с применяемой терапией достигала 2—2,5 лет» [4]. Среди препаратов для лечения острого лейкоза авторы называли кортикостероидные гормоны, 6-меркаптопурин, антагонисты фолиевой кислоты, включая метотрексат. Для лечения резко выраженных опухолевых разрастаний использовалась рентгенотерапия. Уже в это время начинала воплощаться в клиническую практику идея трансплантации костного мозга от здоровых лиц (медуллотрансфузия). Однако несовершенство методов исследования иммунной совместимости между донором и больным приводило к тому, что после трансплантации костного мозга продолжительность жизни пациентов была ниже, чем при лечении острого лейкоза кортикостероидами и пуринетолом (6-меркаптопурином).
В 60-х — начале 70-х годов появились и стали с успехом внедряться в клиническую практику новые цитостатические препараты. Был синтезирован цитозин-арабинозид, который в дальнейшем стал базисным препаратом в терапии ОМЛ. При использовании L-аспарагиназы были получены первые обнадеживающие результаты у больных ОЛЛ. В это же время началось изучение противоопухолевой активности антрациклиновых цитостатиков (даунорубицин, адриабластин), которые стали применять для лечения как ОМЛ, так и ОЛЛ. Была продемонстрирована более высокая эффективность комбинаций химиопрепаратов (полихимиотерапия) по сравнению с монотерапией. Так, если у детей с острым лейкозом при монотерапии преднизолоном полная ремиссия наблюдалась в 57%, а винкристином — в 47%, то при сочетании указанных препаратов она отмечалась в 84%. Были предложены комбинации винкристина с метотрексатом, 6-меркаптопурином и преднизолоном (схема ВАМП), аналогичная схема с заменой винкристина циклофосфаном (ЦАМП), цитозин-арабинозида (цитарабина) с преднизолоном и винкристином. К этому времени к терапии острого лейкоза начал постепенно применяться дифференцированный подход в зависимости от принадлежности опухолевых клеток к миелоидному или лимфоидному ростку кроветворения.
В начале 70-х годов появились сообщения о полихимиотерапии ОЛЛ с использованием L-аспарагиназы, винкристина и преднизолона. При лечении детей по этой схеме удалось получить 93% ремиссий. Достижения в лечении ОЛЛ у детей были положены в основу создания программ терапии взрослых пациентов. Указанные препараты у взрослых больных ОЛЛ относят к наиболее активным агентам и в настоящее время. Комбинирование цитарабина с даунорубицином (рубомицином) позволило значительно увеличить эффективность лечения ОМЛ. К концу 70-х годов прогноз при острых лейкозах принципиально изменился, базисной терапией ОМЛ стала схема «7+3» (цитарабин по 100 мг/м2 2 раза в сутки в течение 7 дней, рубомицин 45 мг/м2 1 раз в сутки в течение 3 дней), которая позволила значительно улучшить непосредственные и отдаленные результаты лечения этого заболевания. Частота полных ремиссий увеличилась до 58—64%, а 5-летняя безрецидивная выживаемость составила 10—21% [5—7].
Терапия ОМЛ
В настоящее время основным методом лечения острых лейкозов является полихимиотерапия, которая включает несколько этапов. I — индукция (достижение) ремиссии, направленная на уничтожение или значительное уменьшение объема опухолевого клона и нормализацию кроветворения. II — консолидация ремиссии, целью которой является уничтожение оставшихся (резидуальных) лейкемических клеток. III этапом является поддерживающая терапия, преследующая те же цели, что и консолидация, однако потенциально воздействующая на опухолевые клетки, пережившие предыдущие этапы лечения. Большинство исследователей считают, что необходимость в поддерживающем лечении зависит от характера терапии, проводимой на этапах индукции и консолидации ремиссии. В том случае, если лечение было интенсифицировано на этапе консолидации ремиссии, проведение поддерживающей терапии может быть необязательным. На сегодняшний день в целом ряде исследований в качестве альтернативы поддерживающей терапии используется трансплантация гемопоэтических стволовых клеток (ГСК).
Современные программы лечения ОМЛ включают в себя на этапе индукции ремиссии базисную антрациклин-цитарабиновую комбинацию (схема «7+3»). В ряде протоколов этот лечебный этап модифицируют за счет добавления других химиопрепаратов (этопозид, тиогуанин), замены рубомицина другими антрациклиновыми препаратами и их аналогами (идарубицин или митоксантрон), эскалации доз цитарабина, использования комбинации цитарабина с другими химиопрепаратами (флударабин, топотекан).
В течение последних 20 лет характер постремиссионной терапии претерпел значительные изменения. В настоящее время в большинстве лечебных протоколов преимущественно у больных моложе 60—65 лет проводится интенсификация лечения путем эскалации доз цитарабина, что позволяет увеличить безрецидивную выживаемость, уменьшить общую продолжительность химиотерапии, а также отказаться от проведения длительной (на протяжении 2 лет) поддерживающей терапии низкими или стандартными дозами цитостатиков. Перечисленные лечебные подходы в целом позволяют получить ремиссии более чем у 70% больных, а также увеличить 5-летнюю безрецидивную выживаемость до 45—50% [8, 9]. При отдельных прогностически благоприятных вариантах ОМЛ, в частности с цитогенетическими аномалиями inv16, t(8;21), при проведении интенсивной консолидационной терапии высокими дозами цитарабина частота полных ремиссий и 5-летняя общая выживаемость достигли 91 и 65% соответственно [10, 11].
Важной составляющей современной терапии ОМЛ является трансплантация ГСК. Источником ГСК служит костный мозг или периферическая кровь. При ОМЛ, как и при других гемобластозах, применяют аллогенную трансплантацию ГСК от родственного или неродственного донора и аутологичную трансплантацию (трансплантация собственных ГСК при отсутствии поражения костного мозга, т.е. в периоде ремиссии). Кроме того, проводятся аллогенная трансплантация ГСК пуповинной крови и трансплантация костного мозга или ГСК из периферической крови от гомозиготного близнеца (сингенная трансплантация), однако два последних метода используются крайне редко. Аллогенная трансплантация, как и химиотерапия, преследует цель уничтожения опухолевых клеток. Нужно подчеркнуть, что указанный метод лечения является этапом терапии ОМЛ и не может рассматриваться как замена химиотерапии. Трансплантация схематично осуществляется следующим образом. Сначала больному проводится так называемая миелоаблативная (уничтожающая как нормальное, так и опухолевое кроветворение) химио- и/или лучевая терапия, которая иначе называется режимом кондиционирования. Затем больному осуществляется инфузия ГСК. Противоопухолевый эффект аллогенной трансплантации получают за счет не только миелоаблативной химиотерапии, но и развития реакции «трансплантат против лейкоза», при котором донорские иммунокомпетентные клетки действуют на лейкемические клетки реципиента, пережившие терапию высокими дозами цитостатиков. Основной проблемой при проведении аллогенной трансплантации ГСК является высокий уровень летальности в посттрансплантационном периоде из-за развития тяжелых инфекционных осложнений в период индуцированной миело- и иммунносупрессии, органной токсичности, острой и хронической форм болезни «трансплантат против хозяина». По данным ряда исследователей, даже при родственной трансплантации летальность может достигать 10—25%. Аллогенная трансплантация ГСК проводится главным образом пациентам в возрасте до 55 лет, которые имеют HLA-совместимого родственного донора. В ряде случаев пациентам с высоким риском развития рецидива или рефрактерным течением заболевания может быть выполнена аллогенная трансплантация ГСК от неродственных HLA-совместимых доноров. Необходимость тщательного отбора больных из-за высокой летальности, строгих показаний к этой процедуре (состояние и характеристика болезни и больного) и низкая вероятность соответствия донора рецепиенту приводят к тому, что трансплантация осуществляется не более чем у 20—25% больных.
В последние годы особой областью клинических исследований стала аллогенная трансплантате ГСК с режимом кондиционирования пониженной интенсивности, характеризующимся меньшей токсичностью. Этот вид трансплантации позволяет увеличить возрастные рамки больных до 70 лет. При аутологичной трансплантации ГСК крайне редко наблюдается такое осложнение, как болезнь «трансплантат против хозяина», которое с высокой частотой регистрируется при аллогенной трансплантации ГСК и является одной из наиболее частых причин посттрансплантационной летальности. С другой стороны, аутологичная трансплантация ГСК связана с более высоким риском развития рецидивов за счет отсутствия феномена «трансплантат против лейкоза» и возможной опухолевой контаминации реинфузированных ГСК. В связи с этим аутологичная трансплантация не проводится при ранних рецидивах заболевания и у пациентов, у которых не достигнута полная ремиссия, так как в этом случае риск опухолевой контаминации значительно повышается.
Несмотря на достигнутые успехи, позволившие считать ОМЛ потенциально излечимым заболеванием, в настоящее время большое внимание уделяется поиску подходов к улучшению результатов лечения: изучению биологических особенностей ОМЛ, поиску факторов прогноза с разработкой дифференцированных программ терапии в соответствии с вариантами заболевания. ОМЛ характеризуются большим разнообразием морфологических, иммунологических, цитогенетических характеристик лейкемических клеток и клинических проявлений. Прогностическая роль отдельных признаков к настоящему времени хорошо изучена и учитывается при выборе терапии. Одним из самых простых для оценки, но, безусловно, наиболее важных факторов прогноза при ОМЛ является возраст больных. По данным ряда исследовательских групп, наиболее выраженные различия в результатах терапии наблюдаются в возрастных группах до 60 лет и старше. Лишь 50% из них проявляют чувствительность к индукционной терапии, при этом безрецидивная выживаемость достигается у 10% [12, 13]. Это объясняется биологическими отличиями ОМЛ у пожилых и более молодых больных. У пожилых пациентов чаще встречаются неблагоприятные хромосомные изменения и комплексные аномалии кариотипа, экспрессия гена множественной лекарственной устойчивости. Очевидны и возрастные различия в переносимости цитостатического лечения. В то же время даже в этой прогностически неблагоприятной группе пациентов существуют определенные поводы для оптимизма. По данным крупной исследовательской группы MRC AML из Великобритании, за последние 30 лет показатель 7-летней выживаемости в группе больных старше 60 лет увеличился с 0 до 14% [14]. Однозначных рекомендаций по лечению пациентов пожилого возраста в настоящее время нет. Существует несколько лечебных подходов: проведение стандартных курсов химиотерапии, редуцированных программ, включая использование малых доз химиопрепаратов (например, цитарабина), симптоматической терапии. Роль интенсивной химиотерапии у большей части пожилых больных сомнительна.
Крайне неблагоприятным течением характеризуются и ОМЛ, имеющие вторичный характер (т.е. развившиеся после применения химиопрепаратов и/или лучевой терапии по поводу предшествующих заболеваний) и трансформировавшиеся из миелодиспластических синдромов. Одними из наиболее важных факторов прогноза, отражающих биологические особенности ОМЛ и учитываемых в большинстве современных программ терапии, являются цитогенетические особенности лейкемических клеток. На основании многочисленных исследований были выделены три прогностические цитогенетические группы: благоприятная, промежуточная и неблагоприятная. Они различаются по показателям эффективности терапии: в группе благоприятного цитогенетического прогноза отмечено 76—91% полных ремиссий с показателем 5-летней общей выживаемости 65%, в группе промежуточного прогноза — 69—86 и 41%, неблагоприятного прогноза — 53—63 и 14% соответственно [10, 15]. Острые лейкозы являются первыми из злокачественных новообразований, при которых прогноз и дальнейшая тактика лечения основываются на результатах генетических исследований. В большинстве современных программ терапии ОМЛ используются лечебные подходы разной интенсивности, которые зависят главным образом от цитогенетического прогноза. В группе благоприятного прогноза (риск развития рецидивов 25% и менее) на постремиссионном этапе применяют 2—4 курса интенсивной химиотерапии, включающей высокие дозы цитарабина. Проводить трансплантацию ГСК (аутологичную и аллогенную) в этой прогностической группе не рекомендуют из-за высокой летальности, что нивелирует потенциальные преимущества трансплантации в отношении противорецидивного эффекта. В группе промежуточного цитогенетического прогноза (частота рецидивов 40—50%) на постремиссионном этапе используют несколько подходов: интенсивную химиотерапию, включающую высокие дозы цитарабина (2—4 курса), комбинацию интенсивной химиотерапии и трансплантации ГСК (аутологичная или аллогенная от родственного HLA-совместимого донора). Приоритетность того или иного лечебного подхода у этой категории больных остается предметом изучения целого рядя крупных рандомизированных исследований. Пациентам из группы неблагоприятного цитогенетического прогноза (частота рецидивов 70—80%) после достижения ремиссии оправдано проведение аллогенной трансплантации ГСК от родственных или неродственных HLA-совместимых доноров.
Одним из основных направлений современных исследований при ОМЛ является изучение молекулярно-биологических аспектов патогенеза ОМЛ. В настоящее время широко исследуется прогностическая значимость молекулярных маркеров, что позволяет выделять новые группы риска внутри существующих групп цитогенетического прогноза и проводить более дифференцированное лечение. К факторам риска относят дупликации гена FLT3, дупликации гена MLL, гиперэкспрессию генов семейства BCL2, гена WT1, EVL-1, а также мутацию гена p53. Большинством исследователей они расцениваются как признаки, имеющие неблагоприятное значение вне зависимости от кариотипа лейкемических клеток. Отдельного внимания заслуживает терапия острого промиелоцитарного лейкоза. В ее основе лежит эффект дифференцировки лейкемических промиелоцитов до зрелых форм под воздействием полностью трансретиноевой кислоты (третиноин, ATRA). Данный препарат явился одним из первых целевых препаратов, применяемых в онкологии. Использование ATRA в качестве индуктора дифференцировки в комбинации с химиопрепаратами в лечении острого промиелоцитарного лейкоза позволило существенно снизить раннюю смертность и число резистентных случаев заболевания, а также достичь высоких показателей отдаленной безрецидивной выживаемости. При этом если ATRA применяется с дебюта заболевания, шанс на выздоровление имеют около 70% больных острым промиелоцитарным лейкозом [16, 17].
Важной современной лечебной стратегией является прицельная (таргетная) терапия, направленная на известные молекулярно-биологические механизмы патогенеза ОМЛ. В последнее время клинические испытания проходят моноклональные антитела к антигену CD33 — гемтузумаб озогамицин, ингибиторы фарнезилтрансферазы — зарнестра, ингибиторы гистондеацетилазы — вальпроевая кислота, ингибиторы протеосом — бортезомиб, гипометилирующих агентов — децитабин и др.
Терапия ОЛЛ
Достижения в лечении ОЛЛ у детей до настоящего времени используются в разработке протоколов терапии у взрослых больных. Применение этих программ лечения позволило излечивать значительную часть взрослых больных ОЛЛ, хотя, к сожалению, и не привело к столь обнадеживающим результатам, наблюдающимся у детей. Это объясняется биологическими различиями заболевания у взрослых и детей. У взрослых пациентов с большей частотой выявляются прогностически неблагоприятные аномалии кариотипа — транслокации t(9;22), t(4;11), регистрируется более высокое число случаев лейкоцитоза в дебюте заболевания. Также существуют различия в метаболизме метотрексата: отмечается снижение аккумуляции в лейкемических клетках его активного метаболита. Очевидны различия в переносимости полихимиотерапии. Более высокая частота развития токсических эффектов вынуждает проводить терапию с редукцией доз препаратов и удлинением межкурсовых интервалов, что приводит к уменьшению ее эффективности. При использовании современных программ терапии полная ремиссия достигается у 70—90% больных, но лишь 30—40% из них переживают 5-летний рубеж без рецидивов.
В 70—80-х годах при лечении ОЛЛ использовались унифицированные (единые для всех вариантов заболевания) программы терапии. Анализ результатов этих исследований позволил выделить целый ряд признаков, имеющих прогностическое значение, что в дальнейшем послужило основой для создания дифференцированных программ терапии ОЛЛ. В настоящее время общепризнанными факторами прогноза при ОЛЛ считают возраст больных (моложе и старше 35 лет), наличие таких неблагоприятных хромосомных аномалий, как транслокации t(9;22) или филадельфийская хромосома (Ph + ОЛЛ), t(4;11), гиперлейкоцитоз в дебюте заболевания (количество лейкоцитов более 30 * 109/л при В-линейных формах ОЛЛ, более 100 * 109/л при Т-линейных ОЛЛ), иммунофенотипические особенности опухолевых клеток, время достижения полной ремиссии (менее или более 2—4 нед), а также число резидуальных лейкемических клеток на разных этапах терапии.
Важное прогностическое значение имеет число факторов неблагоприятного прогноза в дебюте заболевания. По данным D. Hoelzer и соавт. (1988), при отсутствии факторов неблагоприятного прогноза (возраст старше 35 лет, лейкоцитоз, длительное время достижения постоянной ремиссии и неблагоприятный иммунофенотип ОЛЛ) шанс пережить 5-летний рубеж без рецидива имеют около 61% больных, при выявлении 2 факторов — лишь 25%. В то же время никто из пациентов не дожил до указанного срока при выявлении 3 и более прогностически неблагоприятных факторов [18]. Хорошо известно, что иммунофенотип лейкемических клеток определяет особенности клинической картины, прогноз заболевания и эффективность терапии. Среди иммунологических вариантов ОЛЛ к прогностически неблагоприятным относят про-В-ОЛЛ, при котором с высокой частотой определяется t(4;1 1), а также некоторые варианты Т-ОЛЛ. Безусловно, прогностическая значимость тех или иных признаков может рассматриваться только в рамках определенных лечебных программ. Так, применяемые при зрелоклеточных формах В-ОЛЛ стандартные по интенсивности программы терапии характеризовались крайне неудовлетворительными результатами. Полной ремиссии удавалось достичь в среднем у 35% больных, при этом 3-летний рубеж без рецидива переживали не более 33% из них. Применение агрессивной непродолжительной (около 6 мес) блоковой терапии, включающей высокие дозы метотрексата, цитарабина, а также целого ряда других базисных для ОЛЛ препаратов (циклофосфан, антрациклины, винкристин, высокие дозы глюкокортикостероидов и др.), позволило значительно увеличить эффективность терапии этого варианта ОЛЛ. По данным ряда исследовательских групп, в настоящее время полная ремиссия в среднем достигается у 74% больных, 5-летняя безрецидивная выживаемость — у 55%.
В большинстве современных программ терапии ОЛЛ, так же как и при О МЛ, используются лечебные подходы разной интенсивности, зависящие главным образом от принадлежности больного к группе высокого или низкого риска, выделяемой с учетом факторов неблагоприятного прогноза. Таким образом, при ОЛЛ проводится дифференцированная терапия в зависимости от определенного варианта заболевания. Основными принципами терапии ОЛЛ являются ее многокомпонентность с использованием цитостатиков с различными механизмами действия, глюкокортикостероидов, включение этапов индукции, интенсивной консолидации ремиссии, поддерживающей терапии, обязательной профилактики нейролейкемии. Как правило, при всех вариантах ОЛЛ, за исключением зрелоклеточного В-ОЛЛ, этап индукции ремиссии построен по единому принципу. Он включает 2 фазы продолжительностью по 4 нед с использованием таких противоопухолевых препаратов, как вин-кристин, преднизолон, аспарагиназа, рубомицин, цитарабин, 6-меркаптопурин. В различных группах риска этап индукции может различаться. При некоторых вариантах ОЛЛ, характеризующихся крайне неблагоприятным прогнозом (зрелоклеточный В-ОЛЛ, Ph+ ОЛЛ), стандартная терапия проводится по специальным программам. На постремиссионном этапе применяется дифференцированная терапия в зависимости от принадлежности больного к группе высокого или низкого риска. Следует подчеркнуть, что, несмотря на достигнутые успехи в лечении ОЛЛ, вопрос об оптимальной индукционной и постремиссионной терапии на сегодняшний день остается открытым.
Важным фактором прогноза, влияющим на выбор постремиссионной стратегии при ОЛЛ, является число остаточных опухолевых клеток (или минимальная резидуальная болезнь) после этапа индукции и консолидации. Однако необходимо помнить, что даже если минимальная резидуальная болезнь не определяется, это не всегда означает отсутствие вероятности развития рецидива, который в данной ситуации может развиться в 6% случаев [19]. В настоящее время в многоцентровом исследовании, предпринятом учеными из немецкой группы по изучению ОЛЛ, проводится количественное определение минимальной остаточной болезни (количественный ПЦР-анализ) на разных этапах терапии у пациентов в группе стандартного риска, выделенной на основании общепризнанных факторов прогноза. После достижения полной ремиссии и на протяжении года постремиссионной терапии проводится качественное и количественное изучение минимальной резидуальной болезни. При обнаружении остаточной популяции лейкемических клеток после завершения этапа индукции ремиссии и на протяжении первого года терапии у этой категории больных проводится интенсификация терапии за счет трансплантация ГСК. Предварительные результаты исследования свидетельствуют о целесообразности такой тактики [20].
Одно из ведущих мест в современных лечебных протоколах при ОЛЛ отводится трансплантации ГСК. Определение необходимости, времени выполнения и вида трансплантации ГСК остается предметом изучения целого ряда многоцентровых рандомизированных исследований. По данным Европейской группы по трансплантации (EBMT), за 2002 г. в Европе при ОЛЛ было выполнено в общей сложности 1597 трансплантаций ГСК, из них 82% составили аллогенные и 18% — аутологичные. Большинство (73%) аутологичных и почти половина (46%) аллогенных трансплантаций выполнялись в период полной ремиссии. При трансплантации костного мозга в период 1-й полной ремиссии показатель 5-летней безрецидивной выживаемости составил 49%, во 2-й период и при резистентном течении заболевания — 31 и 18% соответственно. Показания к проведению трансплантации ГСК продолжают обсуждаться.
Важной составляющей современной терапии ОЛЛ является использование новых молекулярно-на-правленных препаратов. Примером тому может служить ингибитор ABL-тирозинкиназы (препарат има-тиниб, коммерческое название гливек) при Ph+ОЛЛ. Известно, что этот вариант ОЛЛ характеризуется крайне неблагоприятным прогнозом. При проведении стандартной терапии продолжительность ремиссии не превышает 9—16 мес, при этом ни один из пациентов не переживает 5-летнего рубежа наблюдения. Использование аллогенной трансплантации в период 1-й полной ремиссии позволило значительно улучшить отдаленные результаты терапии. Показатели 5-летней общей выживаемости, по данным ряда исследований, составили 27—65%, однако у 30% больных развивались рецидивы заболевания. С началом применения иматиниба совместно с цитотоксическими препаратами полной ремиссии удается достичь у 90—95% больных, в том числе и молекулярной ремиссии. Проведение аллогенной трансплантации в постремиссионном этапе после комбинированной терапии цитостатиками и иматинибом позволяет увеличить 5-летнюю безрецидивную выживаемость до 78% [21].
В настоящей статье мы попытались обобщить опыт лечения лейкозов в передовых клиниках, представив как исторический опыт, так и современные результаты и особенности терапии. Безусловно, создание новых все более дифференцированных программ терапии при острых лейкозах должно базироваться на современных достижениях практически во всех областях естественных наук. В то же время комплексное исследование цитогенетических, молекулярно-биологических, а порой и иммунофенотипических особенностей заболевания в большинстве отечественных клиник остается недоступным. В этих условиях необходимо проводить дифференцированную терапию в зависимости от таких факторов прогноза, как возраст больных, количество лейкоцитов в дебюте заболевания, время достижения полной ремиссии. Вместе с тем такой подход не может не отразиться на результатах терапии.
Успехи, достигнутые в последние десятилетия в терапии острых лейкозов, в немалой степени связаны с сопроводительной терапией. Именно сопроводительная терапия, направленная на предупреждение и лечение осложнений, развивающихся в период подавления костномозгового кроветворения после цитостатического воздействия, позволяет провести основное лечение в необходимом объеме и в нужные сроки. Сопроводительное лечение в условиях высокого риска осложнений, вызываемых самой химиотерапией, в настоящее время приобрело настолько важное значение, что стало рассматриваться в качестве отдельного направления современной онкологии. Прогресс в понимании биологических особенностей опухолевых клеток и патогенеза лейкозов привел к созданию новых методов диагностики и оценки результатов терапии, а применение новых препаратов и методов лечения существенно изменило прогноз у больных с этими грозными заболеваниями. В результате достигнутых успехов в течение последних 20 лет острые лейкозы стали относить к потенциально излечимым болезням, что требует пересмотра ранее существовавшего отношения врачей к этим заболеваниям как к абсолютно фатальным. В настоящее время больные острыми лейкозами должны получать максимально эффективное лечение в условиях специализированных клиник, так как целью терапии является излечение.
Авторы: О.Ю. Баранова, А.Д. Ширин ГУ РОНЦ им. Н.Н. Блохина РАМН
«Вместе против рака. Врачам всех специальностей» № 1 2006 г.
ЛИТЕРАТУРА
1. World Health Organization classification of tumors. Pathology and Genetics of tumors of Haematopoietic and Lymphoid tissues. Eds. Jaffer E.S., Harris N.L., Stein H., Vardiman J.W., IARS Press, Lyon, 2001.
2. Ларионов Л.Ф. Химиотерапия злокачественных опухолей. М., 1962. с. 464.
3. Осеченская Г.В. Клиника острого (подострого) лейкоза. Дисс. докт. мед. наук. Москва, 1961.
4. Кассирский И.А., Алексеев Г.А. Клиническая гематология. М., 1962. с. 811.
5. Preisler H., David R., Krishner J. et al. Comparison of three remission induction regimens and two postinduction strategies for the treatment of acute non-lymphocytic leukemia: a Cancer and Leukemia Group Study. Blood 1987;69: 1441-9.
6. Rai K., Holland J., Glidewell O. et al. Treatment of acute myelocytic leukemia: a study by Cancer and Leukemia Group B. Blood 1981; 58: 1203-12.
7. Yates J., Glidwell O., Wiernik P. et al. Cytosine arabinoside with daunorubicin or adriamycin for therapy of acute myelocytic leukemia: a CALGB study. Blood 1982;60: 454-62.
8. Mayer R., Davis R., Schiffer С et al. Intensive postremission chemotherapy in adults with acute myeloid leukemia. N Engl J Med 1994;331: 896-903.
9. Zittoun R., Mandelli F., Willemze R. et al. Autologous of allogeneic bone marrow trans plantation compared with intensive chemotherapy in acute myelogenous leukemia. N Engl J Med 1995; 332: 217-23.
10. Grimvade D., Walker H., Oliver F. et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1.612 patients entered into MRC AML 10 trial. Blood 1998;92:2322-33.
11. Haferlach T., Bennett J., Loffler H. et al. Acute myeloid leukaemia with translo- cation (8;21). Cytomorphology, dysplasia and prognostic factors in 41 cases. AML Cooperative Group and ECOG. Leuk Lymphoma 1996; 23: 227-34.
12. Lowenberg B., Suciu S., Archimbaud E. et al. Mitoxantrone versus daunorubicin in induction-consolidation chemotherapy - the value of low-dose cytarabine for main tenance of remission, and assessment of prognostic factors in acute myeloid leukemia in the elderly: final report. European Organization for the Research and treatment of Cancer and the Dutch- Belgian Hemato-Oncology Cooperative Hovon Group. J Clin Oncol 1998;16: 872-81.
13. Tilly H., Castaigne S., Bordessoule D. et al. Low-dose cytarabine versus intensive chemotherapy in the treatment of ANLL in the elderly. J Clin Oncol 1990; 8: 272-9.
14. Burnett A. Treatment of acute myeloid leukemia. In: Educational book of Fifth Congress of the EHA, June 25—28, 2000, Birmingham UK. P. 51-58.
15. Slovac M., Kopecky K., Cassileth P. et al. Karyotype analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia: a Southwest Oncology Group/Eastern Cooperative Oncology Group study. Blood 2000;96:4075-83.
16. Fenaux P., Chastang C., Chevret S. et al. A randomize comparison of all tran-sretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94: 1192-2000.
17. Fenaux P., Chevret S., Guerci A. et al. Long-term follow-up confirms the benefit of all-trans retinoic acid in acute promyelocyt ic leukemia. Leukemia 2000; 14: 1371—7.
18. Hoelzer D., Thiel. E, Loffler H. et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. Blood 1988; 71: 123-33.
19. Kneba M., Bruggemann M., Gokbuget N. et al. Measurement of minimal residual disease (MRD) after consolidation therapy as a means of early detection of relapse in adult acute lymphoblastic leukemia (ALL) Blood 2005 (ASH Annual Meeting Abstracts); 106. — Abstract 538.
20. Gokbuget N., Raff R., Brugge-Mann M. et al. Risk/MRD adapted GMALL trials in adult ALL. Ann Hematol 2004; 83 (Suppl 1): S129—31.
21. Lee S., Kim Y., Chang-Ki Min et al. The effect of first-line imatinib interim therapy on the outcome of allogeneic stem cell transplantation in adults with newly diagnosed Philadelphia chromosome-posi tive acute lymphoblastic leukemia. Blood 2005; 105: 3449-57.



