Семейный аденоматоз толстой кишки (САТК) является наследственным заболеванием ЖКТ, передающимся по аутосомно-доминантному типу, и характеризуется поражением толстой кишки множеством полипов, нередко с возникновением метаболических нарушений и неизбежным развитием рака в 3—4-м десятилетии жизни [1-3]. Заболеваемость семейным аденоматозом, по данным разных авторов, варьирует в пределах 1,3 на 1 млн населения, что соответствует частоте при рождении приблизительно 1 на 10 000 [4, 5].
Для заболевания характерно развитие в период полового созревания во всех отделах толстой кишки сотен и тысяч истинных аденоматозных полипов. Болезнь начинается, как правило, с так называемого кишечного синдрома — учащения стула, появления примеси крови и слизи в кале, болей в животе. Характерно похудание больных, отставание в физическом развитии от сверстников. Также широко представлен спектр так называемых вне-кишечных проявлений аденоматоза. К ним относят патологическую пигментацию сетчатки глаз, развитие остеом, липом, фибром различной локализации. Индекс малигнизации полипов в случае отсутствия своевременного хирургического лечения составляет 100%, и рак развивается, как правило, уже к середине четвертого десятилетия жизни. Несмотря на большое число публикаций, посвященных семейному аденоматозу, многие вопросы обоснования сроков оперативного вмешательства и связанные с этим проблемы ранней диагностики заболевания остаются нерешенными и в настоящее время.
Актуальность проблемы обусловлена частыми неудовлетворительными результатами лечения, связанными с запоздалой диагностикой аденоматоза и малоутешительными исходами предпринятых операций в отдаленные сроки наблюдения. По данным многочисленных авторов, до 70% самостоятельно обратившихся в поликлинику по месту жительства больных САТК на момент первичного обследования уже имели одну или несколько раковых опухолей толстой кишки. Это обстоятельство, в свою очередь, существенно ухудшает как непосредственные результаты хирургического лечения, так и прогноз для последующей жизни оперированных больных [6-8]. Так, причиной летальных исходов в 60—70% наблюдений в отдаленные сроки после хирургического вмешательства является генерализация злокачественного процесса, несмотря на удаление первичной опухоли толстой кишки [8-10].
Поздняя диагностика САТК сопровождается не только неизбежной злокачественной трансформацией полипов, но и нередко тотальным поражением всех отделов толстой кишки полипами, что приводит к значительному увеличению числа вынужденных операций с формированием постоянного тонкокишечного свища на передней брюшной стенке — илеостомы у людей молодого трудоспособного возраста. В то же время ранняя диагностика САТК до развития рака толстой кишки позволяет у ряда больных в случае отсутствия показаний к эндоскопической полипэктомии или полостной операции начать целенаправленное динамическое наблюдение, а при наличии показаний — выполнить резекцию толстой кишки с сохранением ее наименее пораженных полипами сегментов. Такие операции не только позволяют сохранить пассаж кишечного содержимого естественным путем, избежать гибели больных от генерализации злокачественного процесса в отдаленные сроки после операции, но и снижают риск развития рака или интенсивного роста полипов в сохраненных сегментах за счет уменьшения площади слизистой оболочки, являющейся субстратом для роста новых полипов.
Поэтому вопросы ранней диагностики САТК, разработка факторов прогноза течения заболевания для определения сроков хирургического вмешательства, а также вопросы наблюдения за больными и их родственниками не теряют своей актуальности. В связи с относительной редкостью этого заболевания диагностика его, с одной стороны, представляет определенные трудности, но, с другой стороны, облегчается наследственным характером болезни.
Одним из методов ранней диагностики САТК является создание регистра семей, один из членов которых страдает этим заболеванием. Именно сведения обо всех родственниках больного, имеющиеся в регистре, позволяют активно привлекать их к обследованию до развития клинических проявлений аденоматоза. Такой подход, в свою очередь, значительно сокращает число пациентов с развившимся на момент установления диагноза раком толстой кишки с 70 до 3—5% [11-14], а также позволяет определить группы риска, что облегчает раннюю диагностику болезни [15-17].
Однако наличие регистра САТК не позволяет исключить из дальнейшего наблюдения родственников, не унаследовавших заболевание, а также выявить больного аденоматозом еще до развития полипов в толстой кишке и включить его в систему дальнейшего мониторинга. Кроме того, наличие лишь базы данных обо всех родственниках пациента, страдающего аденоматозом, не позволяет разработать факторы прогноза течения болезни у каждого конкретного больного и определить индивидуальную лечебную тактику [18, 19]. В последние десятилетия было установлено, что ответственными за развитие САТК являются мутации, возникающие в гене, расположенном в длинном плече 5-й хромосомы, получившем название ген АРС [20-22].
Проведение молекулярно-генетических исследований, т.е. генетического скрининга, позволяет немедленно дифференцировать больных и здоровых людей среди родственников в одной семье. Выявленные на основании результатов генетического скрининга больные должны включаться в систему мониторинга, а здоровые родственники — сниматься с дальнейшего наблюдения. В то же время определенные трудности, не имеющие однозначного решения, существуют в отношении генетического скрининга у родственников пробанда, имеющего клиническую картину аденоматоза толстой кишки, но не имеющего мутацию в гене АРС [23, 24]. Наличие таких семей еще раз подтверждает нерешенность некоторых вопросов генетического скрининга и мониторинга среди родственников больных.
Клинические наблюдения за больными САТК показали, что сам по себе аденоматоз не является однородным заболеванием и может протекать как весьма агрессивно, так и относительно «доброкачественно» [25, 26]. Основными критериями, на основании которых проводится оценка варианта течения аденоматоза у конкретного больного, являются характер поражения толстой кишки полипами, возраст возникновения рака и характерных жалоб.
При агрессивном варианте течения заболевание проявляется в первом десятилетии жизни, сопровождается появлением во всех отделах толстой кишки нескольких тысяч аденоматозных полипов на фоне глубоких метаболических нарушений, а злокачественная трансформация их наступает на 2-м — в начале 3-го десятилетия жизни [27, 28]. При так называемом классическом варианте аденоматоза его клинические проявления возникают в период полового созревания, т.е. к 14—16 годам, а рак развивается в 3—4-м десятилетии жизни [29, 30]. Кроме того, существовавший ранее однозначный подход, предполагающий установление диагноза САТК при наличии более 100 колоректальных полипов, был отвергнут в связи с выделением так называемой ослабленной формы заболевания с наличием мутации в гене АРС, при которой число полипов, локализующихся, как правило, в правых отделах ободочной кишки, может быть менее ста, а развитие рака наступает на 5—6-м десятилетии жизни [31, 32].
Выделение этих форм течения САТК способствует дифференцированному подходу к лечению каждого больного в зависимости от варианта развития болезни. При генетическом обследовании больных САТК было замечено, что каждому клиническому варианту течения заболевания соответствуют мутации, расположенные в определенных интервалах гена АРС [33, 34]. Такая корреляция между генотипом и фенотипом может служить обоснованием для разработки факторов прогноза течения болезни у конкретного больного и определять индивидуальную лечебную тактику.
До настоящего времени в отечественной литературе нет специальных работ, посвященных вопросам оценки эффективности создания регистра больных САТК для улучшения результатов лечения этого тяжелого заболевания. Отсутствуют сведения о методах проведения, эффективности и прикладном значении для практической медицины генетического скрининга и последующего мониторинга в семьях больных аденоматозом толстой кишки.
Не решены вопросы разработки факторов прогноза течения САТК и определения индивидуальной лечебной тактики у конкретного больного на основании результатов молекулярно-генетических исследований. В зарубежной литературе существуют хотя и многочисленные, но порой противоречивые, особенно в отношении генотип-фенотипических корреляций, публикации, посвященные САТК. В связи с вышеперечисленными обстоятельствами нами проведено исследование, целью которого явилось улучшение ранней диагностики и результатов хирургического лечения больных САТК.
Материалы и методы
Для оценки роли генетического тестирования при наследственном аденоматозе нами совместно с Медико-генетическим научным центром РАМН проведено генетическое исследование у 85 человек в возрасте от 12 до 72 лет, включенных в систему нашего регистра этого заболевания, представляющего сведения о 117 пробандах и 118 активно вызванных для обследования их кровных родственниках. Мы считаем, что генетическое тестирование должно выполняться всем родственникам пробан-дов при условии их согласия на эту процедуру.
Группа 85 генетически обследованных пациентов состояла из 62 пробандов и 23 ранее не обследованных членов их семей, активно вызванных нами для генетического тестирования. Несмотря на то что у 62 пробандов, ранее обследованных в ФГУ ГНЦ колопроктологии Росздрава, диагноз САТК был заведомо известен, с целью выявления варианта мутации в каждой семье и определения закономерностей наследования заболевания у каждого из ее членов генетическое тестирование проводилось как у пробандов, так и у их родственников. Из 85 генетически обследованных мутации в гене АРС выявлены у 46 (54%) человек, у 39 (46%) мутация не обнаружена. Среди 62 пробандов было 29 мужчин и 33 женщины. Возраст пациентов составлял от 17 до 72 лет. Все больные на момент установления диагноза уже имели выраженную клиническую картину, характерную для САТК.
Запоздалая диагностика в этой группе больных сопровождалась значительной интенсивностью поражения различных отделов толстой кишки полипами и высокой частотой развития рака уже на момент установления диагноза.
У подавляющего числа пациентов — 39 человек (62,9 %) полипами были поражены все отделы толстой кишки, что нередко не позволяет выполнять операции с сохранением естественного пассажа кишечного содержимого. Только у 23 (37,1%) пациентов различные отделы толстой кишки были свободны от полипов, что является благоприятным условием для операций с сохранением анальной дефекации. Из 62 обследованных пробандов солитарная опухоль толстой кишки диагностирована у 15 (24,2%), первично-множественный рак — у 3 (4,8%). Генерализация злокачественного процесса с наличием отдаленных метастазов, подтверждающая запоздалость диагностики в этой группе пациентов, отмечена у 4 (6,5%) больных. Таким образом, у 29% самостоятельно обратившихся в клинику пробандов имелась одна или несколько злокачественных опухолей толстой кишки, а у 6,5% наступила генерализация злокачественного процесса. Анализ состояния гомеостаза в группе пробандов показал, что у 27 (43,5%) из них имелись различного рода метаболические нарушения, потребовавшие длительной коррекции как в пред-, так и в послеоперационном периоде.
Запоздалая диагностика САТК при самостоятельном обращении пациентов к врачам сопровождалась значительной частотой вынужденных операций с формированием противоестественного заднего прохода, достигающим 21% (13 больных). Хирургические вмешательства с сохранением наименее пораженных полипами отделов толстой кишки выполнены у 38 (61,3%) пациентов. Лишь у 11 (17,7%) больных после установления диагноза оказалось возможным ограничить мероприятие эндоскопической полипэктомией. Больных, которым не потребовались лечебные мероприятия, но было необходимо лишь динамическое наблюдение, не оказалось. Основная масса вызванных для обследования 23 родственников больных были детьми пробандов — молодыми людьми в возрасте от 12 до 29 лет, и лишь 2 женщины в возрасте более 50 лет относились к представителям старшего поколения семей пробандов.
Следует подчеркнуть, что из 23 активно привлеченных к обследованию родственников только 1 пациент предъявлял жалобы на периодические боли в животе и незначительную примесь крови в кале, у 22 человек жалоб не было, и они считали себя здоровыми людьми. После проведения молекулярно-генетического тестирования 5 человек из этой группы, не унаследовавших мутацию от имеющих ее пробандов, сочтены нами здоровыми, у 11 диагноз САТК был установлен на основании только данных генетического исследования, что подтверждено при коло-носкопии. Остальным 7 пациентам, у которых мутацию выявить не удалось, но имелись пробанды с клинически подтвержденным диагнозом семейного аденоматоза без мутации, было выполнено эндоскопическое исследование толстой кишки. По результатам колоноскопии у 3 человек выявлено различное по интенсивности поражение полипами толстой кишки, а у 4 полипы отсутствовали. Несмотря на это, пациенты имеющие больных родственников с невыявленной мутацией и сами не имеющие мутации, должны оставаться под наблюдением как составляющие группу риска в отношении развития аденоматоза в дальнейшем.
Накопление клинических наблюдений осуществлялось на базе 1-го хирургического отделения ФГУ ГНЦ колопроктологии Росздрава и данных медицинского архива этого учреждения.
Генетические исследования выполнялись в Медико-генетическом научном центре РАМН. Клинические и анамнестические данные собирали методом поодиночной регистрации про-бандов — больных, наблюдавшихся в 1-м хирургическом отделении, а также их родственников, составляющих группу риска развития аденомато-за, активно вызванных для обследования в период с 2000 по 2006 г.
Сбор материала осуществляли клинико-гене-алогическим методом, регистрируя паспортные данные, клинические проявления заболевания у пробанда, а также его кровных родственников, результаты инструментальных и лабораторных обследований, а также родословную пробанда. Для наглядности и возможности оценки родословных строили генеалогическое древо каждой семьи.
С помощью клинико-генеалогического метода обследования у пробандов были собраны сведения о наличии заболевания среди их родственников. Особое внимание уделялось клинической картине течения заболевания в конкретной семье: характеру наследования аденоматоза по материнской или отцовской линии, времени появления первых жалоб, характеру впервые установленного диагноза и анализу причин его расхождения с истинным диагнозом, времени развития рака толстой кишки, наличию метаболических нарушений к моменту предпринятого хирургического вмешательства и причин летальных исходов в отдаленные сроки.
Верификация и коррекция генеалогических данных, полученных в результате опроса пробандов, осуществлялись путем приглашения родственников разных степеней родства на обследование, в том числе и генетическое тестирование, независимо от наличия или отсутствия клинических проявлений заболевания. Обследование родственников проводилось как в поликлинике ГНЦ колопроктологии, так и в условиях стационара 1-го хирургического отделения сотрудниками этого подразделения. Выполняли ректороманоскопию, колоноскопию с осмотром всех отделов толстой кишки с целью выяснения интенсивности их поражения полипами и выявления признаков озлокачествления. Колоноскопия дополнялась ирригоскопией с целью визуализации и документации распределения полипов по толстой кишке и установления признаков их малигнизации. Также проводились клинико-биохимические и лабораторные исследования для выяснения степени метаболических нарушений.
Из существующих на сегодняшний день методов генетического тестирования нами выбраны методики электротрофоретической миграции маленьких фрагментов неизмененной и мутантной ДНК — SSCA с последующим автоматическим ДНК-секвенированием. Методика генетических исследований заключалась в следующем: на основании данных регистра, который служил базой для рекрутирования больных на генетическое исследование, выбирался пробанд — член семьи с достоверно установленным диагнозом САТК. Затем у пробанда брали кровь, являющуюся субстратом для дальнейшего выделения ДНК, из периферической вены в стандартную лабораторную пробирку в количестве 5—10 мл без консерванта.
Мутантные фрагменты ДНК гена АРС определяли первоначально с помощью электрофоретиче-ского метода с последующим подтверждением наличия мутации и выявлением ее характеристик путем автоматического ДНК-секвенирования.
Результаты и обсуждение
Как уже говорилось, первоочередной задачей генетических исследований является проведение скрининга среди кровных родственников больных САТК и осуществление ранней диагностики этого заболевания до развития клинических проявлений.
Из 85 генетически обследованных больных мутация в гене АРС выявлена у 46 (54%), у 39 (46%) мутация не обнаружена. В группе 46 больных с выявленной мутацией 35 человек являлись пробандами, а 11 — их родственниками в возрасте от 12 до 27 лет, активно вызванными нами для генетического скрининга. Из 11 родственников 10 на момент обследования жалоб не предъявляли и лишь 1 больной отмечал боли в животе на протяжении 6 мес. Эта группа, несмотря на отсутствие клинических проявлений заболевания у подавляющего числа обследованных, представляла наибольший интерес, так как именно выявление у них мутации при генетическом скрининге явилось поводом для проведения колоноскопии, при которой у 10 пациентов выявлены полипы толстой кишки. У одного пациента 14 лет, имеющего больного аденомато-зом отца с мутацией в гене АРС, обнаружена идентичная мутация, но при эндоскопическом обследовании полипы толстой кишки не обнаружены. Это наблюдение является ярким примером возможностей генетического тестирования в выявлении САТК на доклинической стадии. Несмотря на отсутствие полипов на момент первичного обследования, этот пациент отнесен нами к категории больных аденоматозом и взят на строгое динамическое наблюдение.
Проведя генетические исследования, мы установили, что характер мутации и ее локализация одинаковы у всех больных — членов одной семьи (рис.1).
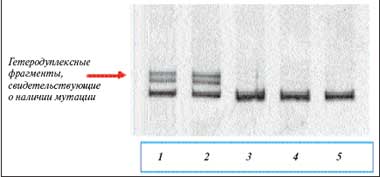
Рис. 1. Генетический скрининг среди кровных родстенников в семье больного аденоматозом толстой кишки ( 1 и 2 — пораженные члены семьи). Электрофореграмма: 1 — пациентка (пробанд), 2 — сын пациентки, 3 — мать пациентки, 4 и 5 — родные братья
Эта закономерность, по нашему мнению, облегчает проведение генетического тестирования у остальных родственников пробанда, исключая необходимость картирования всего гена АРС.
Таким образом, генетический скрининг в группе больных с наличием мутации позволил выявить САТК на доклинической стадии у 11 человек.
Группа пациентов с отсутствием мутации в гене АРС состояла из 39 человек, из них 27 — пробанды с заведомо установленным диагнозом САТК, а 12 человек — активно вызванные нами для обследования родственники в возрасте от 16 до 55 лет, не предъявлявшие жалоб. Из 12 генетически обследованных родственников 5 имели пробандов с установленной мутацией в гене АРС, но сами эту мутацию не унаследовали. Отсутствие у них мутации, имеющейся у их пробандов, позволяет считать их на основании законов генетики здоровыми и снять с дальнейшего мониторинга. Наибольшие трудности при генетическом скрининге представляют семьи больных аденома-тозом, в которых не удается выявить мутацию в гене АРС у пораженного болезнью пробанда.
Подобная ситуация отмечена нами у остальных 7 из 12 активно вызванных родственников без мутации, являвшихся членами семей, в которых пробанд был болен аденоматозом толстой кишки, но мутация у него также отсутствовала. При проведении колоноскопии у 3 из этих 7 родственников выявлены полипы толстой кишки, в связи с чем они были отнесены нами в категорию больных аденоматозом и взяты на динамическое наблюдение. По нашему мнению, наличие фенотипических признаков заболевания при отсутствии мутации в гене АРС является феноменом, требующим дальнейшего изучения.
У 4 из 7 родственников в возрасте от 17 до 26 лет полипов не было. Однако, принимая во внимание наличие у них пробандов, страдающих САТК и не имеющих мутации в гене АРС, мы не можем однозначно считать этих 4 родственников здоровыми. 8 связи с возможными, но пока еще не изученными мутациями иной локализации, чем ген АРС, эти больные имеют, по нашему мнению, потенциальный риск развития аденоматоза в более старшем возрасте и нуждаются в дальнейшем наблюдении.
Анализируя группу пробандов и их родственников с невы-явленной мутацией, мы считаем, что отсутствие полипов в толстой кишке на момент обследования родственника из семьи с невыявленной мутацией не является поводом для снятия его с дальнейшего мониторинга. Наличие полипов в толстой кишке, даже при отсутствии мутации, требует относить таких родственников к группе больных аденоматозом и проводить за ними динамическое наблюдение, по крайней мере до 50 лет, так как после этого возраста риск развития аденоматоза крайне мал. Более того, мы считаем необходимым в таких семьях расширить генетические исследования с целью возможного выявления мутаций, ответственных за возникновение заболевания в других хромосомах.
Немаловажным представляется анализ результатов лечения 14 больных с установленным нами диагнозом САТК из 23 активно вызванных родственников. Из этого анализа исключены оставшиеся 9 человек, 5 из которых сняты с учета как не унаследовавшие заболевания и, следовательно, избежавшие необходимости проведения неприятных диагностических манипуляций и пожизненного стресса, а 4 взяты под динамическое наблюдение и находятся в группе риска, но не имеют полипов.
Проведенный генетический скрининг в совокупности с данными Регистра позволил не только избежать развития рака в анализируемой группе, но и значительно уменьшить число пациентов с интенсивным поражением полипами толстой кишки. У 6 (42,9 %) свободными от полипов были один или несколько ее отделов, у такого же числа имелись единичные полипы небольших размеров, у одного пациента с выявленной мутацией полипы отсутствовали. Лишь у одного больного обнаружено тотальное поражение толстой кишки полипами диаметром до 0,5 см. Ранняя диагностика аденоматоза с помощью молекулярно-генетического тестирования, явившаяся императивным поводом для проведения колоноскопии, сыграла значительную роль в улучшении результатов лечения
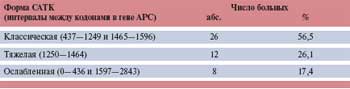
Таблица 1. Распределение больных (n=46) по формам клинического течения САТК в группе больных с отсутствием и наличием мутации в гене АРС
этой группы больных по сравнению с самостоятельно обратившимися к врачам пациентами, являющимися пробандами. Операции с сохранением естественного пассажа кишечного содержимого выполнены 6 (42,9%) больным, удаление толстой кишки с формированием илеостомы произведено лишь одному пациенту. Полипэктомия выполнена 5 (35,8%) пациентам, а 2 (14,2%) больным до сих пор проводится лишь динамическое наблюдение.
Другая не менее важная задача молекулярно-генетических исследований — выявление клини-ко-генетических взаимосвязей при САТК, позволяющих определить факторы прогноза развития болезни и помочь хирургам в разработке индивидуальной лечебной тактики и установлении оптимальных сроков хирургического вмешательства у конкретного пациента. Основой для нашего анализа послужила группа из 46 больных с выявленной мутацией.
Изучая особенности проявлений болезни у конкретного больного с целью выделения той или иной формы проявления САТК, мы использовали ранее приведенные клинические критерии, характеризующие каждую из форм аденоматоза — начало появления жалоб, наличие или отсутствие метаболических нарушений, число колоректаль-ных полипов, а также особенности их локализации по толстой кишке, возраст развития рака.
Результаты распределения этих больных по вариантам клинического течения САТК на основании вышеизложенных критериев представлены в табл. 1. Из табл. 1 видно, что наиболее частой клинической формой проявления аденоматоза является классическая, причем у больных с выявленной мутацией ее доля превышает 70%; второй по частоте является тяжелая форма, меньшее число наблюдений приходится на ослабленную форму аденоматоза. Далее, на наш взгляд, наиболее интересным представляется выявление взаимосвязи локализации мутации в гене АРС с клиническим течением САТК. При анализе клинико-генетических зависимостей в группе больных с выявленной мутацией мы использовали так называемую шкалу гено-тип-фенотипических корреляций, предложенную в 1998 г. G.S. Hernegger и соавт. (рис. 2).
Согласно этой шкале, классической форме САТК соответствуют интервалы между кодонами 437—1249 и 1465—1596, тяжелой — между кодонами 1250—1464, ослабленной — между кодонами 0—436 и 1597—2843, т.е. по обоим концам гена

Рис. 2. Интервалы, характерные для различных форм САТК
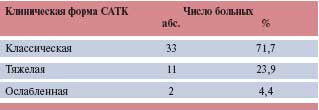
Таблица 2. Распределение больных (n=46) с выявленными мутациями по интервалам шкалы генотип -фенотипической корреляции в зависимости от локализации мутации
Первым этапом анализа явилось распределение наших больных в зависимости от локализации выявленных мутаций в гене АРС с использованием шкалы генотип-фенотипических корреляций (табл. 2).
Из табл. 2 видно, что больше половины больных имеют мутации, локализующиеся в интервалах, характерных для классической формы течения аденоматоза, почти у четверти пациентов — в интервале тяжелой формы, наименьшая доля приходится на интервалы, соответствующие ослабленной форме заболевания.Затем на основании оценки клинического течения аденоматоза у 46 больных и данных, полученных при генетическом тестировании, нами проведен собственный анализ соответствия клинической формы заболевания с детерминирующим ее интервалом кодонов гена АРС. Таким образом изучены генотип-фенотипические корреляции у конкретного больного (табл. 3).Оказалось, что из 33 пациентов с классической формой заболевания у 25(75,7%), т.е. у большинства обследованных, локализация мутации совпадала с интервалом, характерным для классического аденоматоза.У всех 11 больных с тяжелым клиническим течением заболевания локализации мутаций полностью соответствовали интервалу кодонов, характерному для этой формы полипоза.Из 8 пациентов с мутациями в интервалах, характерных для ослабленной формы семейного аденоматоза толстой кишки, у 7 человек заболевание клинически протекало в классической форме. Лишь у одного пациента, имеющего ослабленную форму течения заболевания, мутация располагалась в характерном именно для этой формы аденоматоза интервале кодонов. В то же время у одного пациента, отнесенного нами по клинической картине в группу ослабленной формы аденоматоза, мутация располагалась в интервале, характерном для классической формы течения заболевания.
Анализируя результаты генотип-фенотипических коррелляций, мы пришли к заключению, что полное совпадение клинической формы аденоматоза толстой кишки с характерными для нее интервалами между ко-донами в гене АРС отмечается в группе больных с тяжелым течением аденоматоза (у 11 из 11 пациентов). Следовательно, при выявлении мутации в кодо-нах 1250—1464 еще до проведения клинико-инструменталь-ного обследования мы можем прогнозировать развитие тяжелого течения аденоматоза.Выявлен высокий процент (75) совпадений между клиническими проявлениями и соответствующими интервалами в группе больных с классическим течением заболевания. Поэтому при обнаружении мутации в интервалах, характерных для классической формы заболевания, мы с большой вероятностью можем предположить развитие болезни по классическому сценарию.
В то же время если при классической и тяжелой формах аденоматоза нам удалось проследить генотип-фенотипические корреляции, то у больных с ослабленной формой аденоматоза такой четкой корреляции не выявлено. Для выяснения генотип-фенотипических корреляций в отношении этой относительно немногочисленной категории больных требуется дальнейшее накопление опыта клинических наблюдений и данных моле-кулярно-генетических исследований.Полученные результаты изучения генотип-фенотипических корреляций, являясь факторами прогноза развития заболевания, в совокупности с данными клинико-инструментального обследования позволяют определить индивидуальную лечебную тактику у конкретного больного.
При выявлении мутации в интервалах, характерных для тяжелой формы аденоматоза, необходимо проводить хирургическое лечение в возрасте до 20—25 лет в связи с высоким риском развития рака толстой кишки к этому возрасту.При наличии мутации в интервале классической формы аденоматоза следует придерживаться активно-выжидательной тактики с проведением каждые полгода клинического обследования больного и выполнением, по показаниям, эндоскопической полипэктомии. Вопрос об операции необходимо решать по достижении 30 лет в связи с нарастающим риском развития рака толстой кишки в этом возрасте.
Определение лечебной тактики при ослабленной форме аденоматоза должно быть строго индивидуально в связи с отсутствием четко выраженных клинико-генетических корреляций.

Таблица 3. Соответствие клинических форм аденоматоза интервалам шкалы генотип-фенотипических корреляций
Выводы
- Проведение молекулярно-генетических исследований показано всем членам семей больных аденоматозом толстой кишки.
- Выполнение генетического тестирования способствует ранней диагностике САТК без проведения сложных диагностических мероприятий, не всегда приемлемых больными, к которым относится колоноскопия.
- Генетические исследования в совокупности с данными Регистра семей больных аденоматозом позволяют снизить число больных с развившимся раком толстой кишки на момент установления диагноза с 29% в группе пробандов до 0% среди их активно вызванных для генетического обследованния родственников.
- Генетический скрининг в семьях больных аденоматозом способствует выявлению заболевания на доклинической стадии и позволяет включать либо исключать из дальнейшего наблюдения пациентов, унаследовавших или не унаследовавших мутацию в гене АРС, а следовательно, являющихся больными или здоровыми членами семей.
- Индивидуальная лечебная тактика должна базироваться на установленных клинико-генетических корреляциях с учетом разработанных факторов прогноза течения заболевания и выделения различных форм аденоматоза у конкретного больного, что способствует как выбору метода лечения больных, так и определению сроков хирургиче ского вмешательства.
- Современный комплексный подход к обследованию и лечению больных САТК с учетом его наследственного характера и проведением клинико-генетического тестирования улучшает результаты лечения больных за счет ранней диагностики заболевания, своевременного начала и выбора вида лечебных мероприятий, а также определения индивидуальных сроков оперативного вмешательства.
Авторы: А.М. Кузьминов, И.Ю. Сачков, Ю.Ю. Чубаров, А.В. Карпухин, Т.А. Музафарова, Н.И. Поспехова, Т.А. Савельева Государственный научный центр колопроктологии Росздрава
"Вместе против рака. Врачам всех специальностей" №2' 2006
Литература
- 1. Никитин А.М. Хирургическое лечение диффузного полипоза толстой кишки. Автореф. дис. ... докт. мед. наук. М., 1981.
- 2. Ривкин В.Л. Диффузный полипов прямой и толстой кишки (иммунологическое исследование, классификация, клиника, хирургическое лечение). Автореф. дис. ... док. мед. наук. М., 1966.
- 3. Федоров В.Д., Дульцев Ю.В. Проктология. М.: 1984. с. 281—98.
- 4. Ленюшкин А.И. Детская колопроктология: Руководство для врачей. М., Медицина; 1990. с. 253—63.
- 5. Михайлянц Г.С. Обоснование необходимости хирургического лечения и выбор способа операции при диффузном полипозе толстой кишки. Автореф. дис. ... канд. мед. наук. М., 1979.
- 6. Дё С.Е. Хирургическое лечение диффузного полипоза. Здравоохр Киргизии 1986;(6):10-11.
- 7. Камаева Д.К. Результаты хирургического лечения диффузного полипоза толстой кишки. Афтореф. дис. ...канд. мед. наук. М.; 1980.
- 8. Ким С.Д. Летальность при хирургическом лечении диффузного полипоза толстой кишки. В кн.: Проблемы проктологии. Вып. 8. М.; 1987. с. 90-3.
- 9. Никитин А.М., Леонов О.А., Михайлянц Г.С. и др. Осложнения в отдаленные сроки после операции по поводу диффузного полипоза толстой кишки. Хирургия 1979;(10):88-93.
- 10. Jang Y.S., Steinhagen R.M., Heimann T.M. Colorectal cancer in familial adenomatous polyposis. Dis Colon Rectum 1997;40(3):312-6.
- 11. Кузьминов А.М., Карпухин А.В., Музафарова Т.А. и др. Современные принципы скрининга семейного аденоматоза толстой кишки. В сб.: Актуальные вопросы колопроктологии. Материалы I съезда колопроктологов России с международным участием. Самара; 2003. с. 86—7.
- 12. Никитин А.М., Чубаров Ю.Ю., Сачков И.Ю. Клинико-генетические аспекты диффузного полипоза толстой кишки. В сб.: Проблемы колопроктологии. Вып. 15. 1996. с. 211.
- 13. Никитин А.М., Чубаров Ю.Ю., Сачков И.Ю. Оценка эффективности создания регистра диффузного полипоза толстой кишки. Рос журн Гастроэнтерол 1999.
- 14. Campbell W.J., Spence R.A., Parks T.G. Screening of familial polyposis coli in Northern Irland. Coloproctology 1995;17(1):6-9.
- 15. Никитин А.М., Баранов О.Н., Якушин А.В., Богомазов А.М. Результаты лечения больных диффузным полипозом толстой кишки с применением мукозэктомии прямой кишки. В кн.: Проблемы проктологии. Вып. 10. М.; 1989. с. 113—7.
- 16. Никитин А.М., Михайлянц Г.С., Нычкин С.Г., Богомазов А.М. Хирургическое лечение диффузного полипоза толстой кишки. В кн.: Актуальные вопросы реконструктивной и восстановительной хирургии. Ч. 2. Тезисы итоговых работ. Иркутск; 1989. с. 251.
- 17. Howe J.R., Guillem J.G. The genetics of colorectal cancer. Surg Clin North Am 1997_;77:175-95.
- 18. Gebert J.F., Dupon C., Kadmon M. et al. Combined molecular and clinical approaches for the identification of families with familial adenomatous polyposis coli. Ann Surg 1999;229(3):350—61.
- 19. MacDonald F., Morton D.G., Rindl P.M. et al. Predictive diagnosis of familiar adenomatous polyposis with linked DNA markers: population based study. Br Med J 1992;304(6831):869-72.
- 20.Behrends J., Jerchow B.A., Wurtele M. et al. Functional interaction of an axon homolog, conductin, with b-catenin, APC, and GSK3b. Science 1998;280:596-9.
- 21.White R.L. Tumor suppressing pathways.Cell 1998;92:591-2.
- 22.Scott R.J., Froggatt N.J., Trembath R.C. et al. Familial infiltrative fibromatosis (desmoid tumours) (MIM 135290) caused by a recurrent 3' APC gene mutation. Hum Mol Genet 1996;5:1921-4.
- 23.Cromwell D.M., Moore R.D., Brensinger J.D. et al. Cost analysis of alternative approaches to colorectal screening in familial adenomatous polyposis. Gastroenterology 1998;114:893-901.
- 24.Tops C.M., van der Klift H.M., van der Luijt R.B. Non-allelic heterogeneity of famil ial adenomatous polyposis. Am J Med Genet 1993;47:563-7.
- 25.Brensinger J.D., Laken S.J., Luce M.C. et al. Variable phenotype of familial adenomatous polyposis in pedigrees with 3' mutation in the APC gene. Gut 1998;43:548-52.
- 26.Friedl W., Meuschel S., Caspari R. et al. Attenuated familial adenomatous polyposis due to a mutation in the 3' part of the APC gene. A clue for understanding the function of the APC protein. Hum Genet 1996;97:579-84.
- 27.Frayling I.M., Beck N.E., Ilyas M. et al. The APC variants I1307K and E1317Q are associated with colorectal tumors, but not always with a family history. Proc Natl Acad Sci USA 1998;95:10722-7.
- 28.Wu J.S., Paul P., McGannon E.A., Church J.M. APC genotype, polyp number, and surgical options in familial adenomatous polyposis. Ann Surg 1998; 227:57-62.
- 29. Lynch H.T., Smyrk T., McGinn T. et al. Attenuated familial adenomatous polyposis coli (AFAP). A phenotypically and genotypically distinctive variant of FAP. Cancer 1995;76(12):2447-33.
- 30.Petersen G.M., Slack J., Nakamura Y. Screening guidelines and premorbid diagnosis of familial adenomatous polyposis using link age. Gastroenterology 1991; 100:1658—64. 31.Lynch H.T., Smyrk T.C. Classification of familial adenomatous polyposis: a diagnostic nightmare editorial. Am J Hum Genet 1998;62:1288-9.
- 32.Ternent C.A., Lin K.M., Adams D.R. Attenuated familial adenomatous polyposis: characteristics and lifetime risk colorectal and periampullary cancer. Dis Col Rectum (in press).
- 33.Bunyan D.J., Shea-Simonds J., Reck A.C. et al. Genotype-phenotype correlations of new causative APC gene mutations in patients with familial adenomatous polyposis. J Med Genet 1995;32:728—31.
- 34. Caspari R., Olschwang S., Friedl W. et al. Familial adenomatous polyposis: desmoid tumours and lack of ophthalmic lesions (CHRPE) associated with APC mutations beyond codon 1444. Hum Mol Genet 1995;4:337-340.



