А.В. Жаров, Г.Р. Кравченко, Л.Ф. Чернова, Т.Н. Губайдуллина
Челябинский окружной клинический онкологический диспансер.
454087, Россия, г. Челябинск, ул. Блюхера,42, e-mail: roc_chel@mail.ru
Проблема рака яичников является одной из наиболее сложных в современной онкогинекологии. За последние годы смертность от рака яичников остается стабильно высокой и занимает одно из первых мест в структуре смертности от онкологических заболеваний женской репродуктивной системы. Это обусловлено как бессимптомным течением заболевания на ранних стадиях и недостаточной специфичностью методов современной диагностики неопластических процессов яичников, так и отсутствием четко выбранной этиопатогенетической концепции этого вида злокачественных новообразований.
Заболеваемость раком яичников в 2009 году в России составила 16,84 на 100 тысяч женского населения, а смертность - 10,17. Летальность больных в течение первого года жизни –26,4% [12].
На I-II стадии заболевания приходилось 34,4% пациенток, с III-IV стадиями заболевания было выявлено 62,8% больных [10].
Общеизвестно, что одной из главных причин высокой смертности при злокачественных опухолях является их несвоевременное обнаружение. Причина этого заключается в недостаточном распространении в нашей стране скрининговых программ по раннему выявлению рака репродуктивных органов. Одновременно с этим необходимо совершенствовать существующие и разрабатывать новые подходы к адекватной молекулярной противоопухолевой терапии, а также шире внедрять методы первичной и вторичной профилактики [1,2,3].
Совершенствование традиционных методов борьбы с раком (хирургическое вмешательство, лучевая терапия и химиотерапия), а также благодаря революционным открытиям и достижениям в молекулярной биологии, генетике, биохимии, иммунологии и вирусологии, позволило значительно расширить представления о молекулярно-генетической природе рака и глубже понять патогенетические механизмы опухолевого роста [5,13].
К настоящему времени известна довольно обширная (около 40) группа природных соединений, блокирующих развитие гипер- и неопластических процессов в эпителиальных тканях, высокая эффективность которых доказана в экспериментальных и клинических исследованиях. Показано, что такие вещества, являются нетоксичными, а, следовательно, безопасными для здоровых органов и тканей, обладают множественной противоопухолевой активностью, то есть воздействуют на несколько ключевых звеньев процесса канцерогенеза. Особенно успешным оказалось сочетание некоторых из них [6,12].
Два наиболее известных таких соединения – это пищевой индол индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (ЕGCG) являются составляющими препарата промисан. Это инновационая разработка ученых из НИИ молекулярной медицины ММА им. И. М. Сеченова и специалистов отечественных компаний «Миракс-Фарма» и «МираксБиоФарма» (г. Москва). Промисан был выведен на российский рынок в 2007 году.
Уникальность этого препарата обусловлена его способностью блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу и повышению инвазивной активности трансформированных клеток.
Промисан – это таргетный (избирательный) продукт растительного происхождения, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у промисана отсутствуют. Препарат выступает своеобразным помощником, усиливающим действие химиопрепаратов, потому что блокирует ряд факторов роста и формирование гормональных метаболитов, которые являются одним из важных моментов, связанных с ростом опухоли.
Промисан – это средство, восстанавливающее чувствительность резистентных опухолей к лекарственным препаратам, блокирует рост опухолей: деление опухолевых клеток, метастазирование, рост сосудов к опухоли [1,7].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением промисана и без него.
Цель исследования
Целью нашего исследования явилось улучшение результатов лечения больных распространёнными формами рака яичников путём включения в схему комплексного лечения препарата промисан.
Материалы и методы
Исследование проведено на базе гинекологического отделения Челябинского окружного клинического онкологического диспансера за период с 2007 по 2010 год. Контрольная группа была набрана за период с 2007 по 2009 годы. Основная группа - за период с 2009 по 2010 год включительно, когда стали активно применять для комплексного лечения больных раком яичников препарат промисан.
В исследовании участвовали 53 пациентки с распространёнными формами рака яичников (III-IV стадии). Основную группу составили 23 пациентки, которым проведено комплексное лечение по плану: от 2-х до 6-ти циклов НАПХТ с интервалом 3 недели по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2) с последующим хирургическим этапом лечения и 4-6 циклами АПХТ по той же схеме. На всём протяжении лечения больные принимали промисан по 2 капсулы 2 раза в день. Контрольную группу составили 30 пациенток, которым проведено комплексное лечение по тому же плану, но без промисана.
До проведения планируемого лечения с целью уточнения распространенности опухолевого процесса и оценки общего состояния пациенток в обеих группах были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза, исследование опухолевого маркёра СА-125.
Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
После проведения хирургического этапа была уточнена распространённость опухолевого процесса, объём остаточной опухоли. Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия пациенток в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125.
Отдалённые результаты лечения по группам установлены на основании длительности безрецидивного периода, одногодичной выживаемости.
Возраст больных варьировал от 36 до 69 лет. Средний возраст пациенток в основной группе составил 53,1±1,3 года, в группе контроля – 54,3±1,2 года. Сравниваемые группы больных по возрастному критерию репрезентативны. Различия статистически незначимые (р>0,05). Распределение больных по возрасту в процентах представлено на рисунке 1.
Распределение больных по стадиям согласно классификации TNM в основной группе было следующим: Т
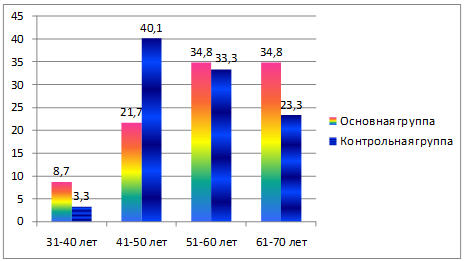
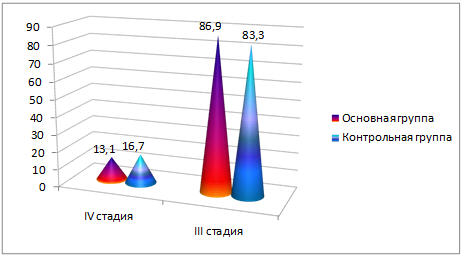
Рис. 2. Распределение больных по стадиям основной и контрольной группах (в процентах).
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная аденокарцинома - 20 (87,0%), муцинозная аденокарцинома - 2 (8,7%), железисто-солидный рак - 1 (4,3%). В контрольной группе: серозная аденокарцинома – 27 (90,0%), муцинозная аденокарцинома - 2 (6,67%), железисто-солидный рак – 1 (3,33%). В обеих группах преобладали больные с серозной аденокарциномой. Различия статистически незначимые (р>0,05). Распределение больных по гистологическому варианту опухоли в процентах представлено на рисунке 3.
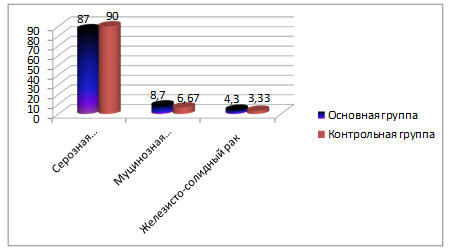
Рис. 3. Распределение больных по гистологической структуре опухоли основной и контрольной группах (в процентах).
Распределение больных по степеням дифференцировки опухоли в основной и контрольной группах показало статистически значимые различия (р<0,05). В контрольной группе преобладали больные с низкодифференцированными вариантами опухоли 17 (74,0%), умеренную дифференцировку имели 5 (21,5%) человек и высокодифференцированный вариант опухоли оказался у 1 (4,3%) пациентки. В контрольной группе преобладали больные с умеренной степенью дифференцировки опухоли – 15 (50,0%), у 9 (30,0%) человек была низкая степень дифференцировки и 6 (20,0%) имели высокодифференцированную опухоль. Распределение больных по степеням дифференцировки опухоли в основной и контрольной группах представлено на рисунке 4.
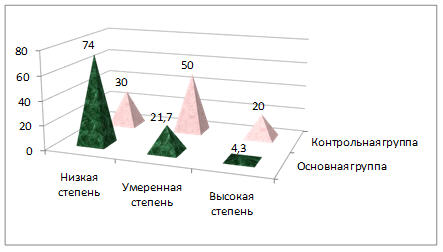
Рис. 4. Распределение больных по степени дифференцировки опухоли основной и контрольной группах (в процентах).
Таким образом, в основной группе преобладали больные с низкодифференцированными, наиболее агрессивными опухолями, с плохим прогнозом заболевания.
Результаты и обсуждение
Сравнительный анализ уровней опухолевого маркера СА-125 до хирургического лечения показал следующее. Уровень СА-125 в основной группе до лечения был повышен у 19 из 20 человек, у 3-х пациенток не было данных до начала лечения. В среднем СА-125 составлял 523,3±18,7 Ед/мл (СА-125 минимальное значение – 14,0 Ед/мл, СА-125 максимальное значение – 2335 Ед/мл). После 2-х циклов НАПХТ он снизился в 2 раза и стал составлять - 236,4±14,8 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 1370 Ед/мл). В группе контроля до начала лечения у 23 пациенток уровень опухолевого маркера СА-125 был повышенным, у 7 больных данные отсутствуют. Среднее значение СА-125 составило 527,5±25,5 Ед/мл (СА-125 минимальное значение – 121,0 Ед/мл, СА-125 максимальное значение – 2550 Ед/мл). После 2-х циклов НАПХТ средний показатель СА-125 составил 415,3±13,7 Ед/мл (СА-125 минимальное значение – 286,0 Ед/мл, СА-125 максимальное значение – 1970 Ед/мл). Различия с основной группой статистически высоко значимые (р<0,01).
В основной группе после 2-х циклов НАПХТ 8 (34,8%) пациенткам было выполнено оперативное лечение в объеме экстирпации матки с придатками и резекции сальника, у одной больной дополненное аппендэктомией и резекцией метастатически измененного участка брыжейки сигмовидной кишки. Объём остаточной опухоли у 6 (26,1%) менее 2 см, у 2 (8,7%) больных более 2 см. В контрольной группе 6 (20,0%) больным после 2-х циклов НАПХТ была произведена операция. Из них трём выполнена экстирпация матки с придатками и резекция сальника, одной из них дополнительно была выполнена аппендэктомия, так как аппендикс входил в опухолевый конгломерат. Двум больным удалось произвести только двустороннюю аднексэктомию и резекцию сальника, и одной пациентке была произведена пробная лапаротомия. Объём остаточной опухоли у 2 (6,7%) пациенток был менее 2 см, у 4 (13,3%) больных более 2 см.
Таким образом, в основной группе после 2-х циклов НАПХТ удалось выйти на хирургическое лечение у каждой третьей пациентки, а в контрольной лишь у каждой пятой. Кроме того, в основной группе 6 (26,1%) больным удалось выполнить оперативное вмешательство с оптимальной циторедукцией (объёмом остаточной опухоли менее 2 см), в сравнении с контрольной группой, где только 2 (6,7%) пациенткам было выполнено оперативное вмешательство с объёмом остаточной опухоли менее 2 см.
Больным, которые не вышли на хирургическое лечение после двух циклов НАПХТ, было продолжено лекарственное лечение до четырёх. После 4-х циклов НАПХТ средний показатель СА-125 у больных основной группы составил 28,3±3,7 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 41,7±6,3 Ед/мл). В группе контроля средний показатель СА-125 составил 35,7±5,3 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 57,1±6,9 Ед/мл). Различия по сравниваемым группам статистически незначимые (р>0,05).
После 4-х циклов НАПХТ 14 (60,9%) пациенткам основной группы было выполнено оперативное вмешательство в объёме экстирпации матки с придатками и резекции сальника. Из них 8 (34,5%) больным с оптимальной циторедукцией (объём остаточной опухоли менее 2 см) и у 6 (26,1%) больных объём остаточной опухоли превышал 2 см. В контрольной группе 18 (60,0%) больным произведен хирургический этап лечения. Из них 15 пациенткам произведена экстирпация матки с придатками, резекция сальника, 2 - экстирпация матки с придатками, биопсия сальника, и 1 больной – двусторонняя аднексэктомия, резекция сальника. Оперативное вмешательство с оптимальной циторедукцией было проведено 7 (23,3%) пациенткам, с неоптимальной циторедукцией 11 (36,7%) больным.
В основной группе 1 (4,3%) больной оперативное лечение было выполнено после 6 циклов НАПХТ в объеме экстирпация матки с придатками и резекции сальника. Визуально остаточной опухоли не определялось. СА-125 у данной пациентки перед операцией составлял 16,8 ЕД/мл. В контрольной группе 6 (20,0%) пациенткам после 6 циклов НАПХТ было выполнено оперативное вмешательство в неполном объеме. Трём из них – экстирпация матки с придатками, двум – двусторонняя аднексэктомия, резекция сальника и одной больной – только резекция сальника. Объём остаточной опухоли более 2 см был у всех пациенток.
В целом после проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы удалось провести оперативное лечение с оптимальной циторедукцией и 9 (30,0±7,7%) пациенткам контрольной группы, пробных операций в основной группе не было. Различия статистически высоко значимые (р<0,01).
Необходимо отметить, что токсические реакции при проведении НАПХТ в обеих группах статистически не отличались. Промисан хорошо переносился всеми больными, на фоне его приема отмечено побочное действие в виде изжоги, так как промисан повышает секрецию желудочного сока. Так, в основной группе изжога отмечена у 30% пациенток, в контрольной - у 7% больных.
Продолжительность жизни пациенток, частота возникновения рецидивов заболевания и смертность являются основными показателями эффективности проведенного лечения у онкологических больных.
У больных распространёнными опухолями яичников (III–IV стадии) в подавляющем большинстве случаев не удаётся удалить весь объём опухоли и процесс приобретает хроническое персистирующее течение. У таких больных трудно достигнуть полного излечения. При лечении достигается стойкая ремиссия. Наблюдаемое повышение уровней СА-125 при прогрессировании заболевания свидетельствует о необходимости мониторинга всех больных, находящихся в ремиссии. Более того, даже если при первичном обследовании у нелеченных больных показатели СА-125 не превышали норму, то в процессе ремиссии анализ на содержание маркеров в крови необходим в связи с возможным вторичным повышением маркеров при рецидиве. Последнее еще раз подтверждает потенциальные возможности клеток рака яичников к изменениям, которые проявляются морфологически и на биохимическом уровне [3].
Говорить о рецидиве заболевания при лечении больных с распространёнными формами рака яичников довольно сложно. Термин «рецидив заболевания» переводится с латинского языка как возврат болезни. Однако после хирургического лечения в основной группе только больных с неоптимальной циторедукцией было 34,8% случаев, а в группе контроля эта цифра достигала 70% наблюдений. Следовательно, говорить об излечении, когда имеется остаточная опухоль неправомочно, а значит, термин «рецидив заболевания» в данной ситуации надо воспринимать условно. Прогрессирование опухолевого процесса оценивали по данным УЗИ, КТ, МРТ в сочетании с повышением уровня опухолевого маркёра СА-125.
Клиническими проявлениями прогрессирования заболевания были: местные рецидивы в малом тазу, метастазы в забрюшинные лимфатические узлы, отдалённые метастазы в легкие, печень (рисунок 5). В наибольшем проценте случаев это были рецидивы в малом тазу в 21,7% в основной группе и 30,0% - в контрольной. В 8,7% случаев рецидив проявился метастазами в забрюшинные лимфатические узлы у больных основной группы и 10,0% пациенток контрольной группы. Отдалённые метастазы в легкие и печень диагностированы несколько в большем проценте случаев у больных основной группы в сравнении с контрольной: в 8,7% это были метастазы в печень и в 4,3 % метастазы в легкие в основной группе, в 6,7% и 3,3% соответственно в контрольной группе.
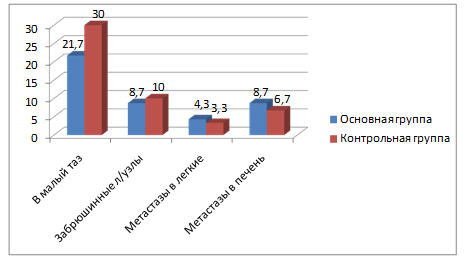
Отмечено, что у пациенток с местным рецидивом в обеих группах, длительность безрецидивного периода была меньше, чем у пациенток с отдалёнными метастазами. Более длительный безрецидивный период отмечался при метастазировании в забрюшинные лимфатические узлы (9 месяцев и более).
В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. Летальность больных раком яичников на первом году жизни после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, одногодичная выживаемость больных раком яичников составляет 63% [2].
Так как основная группа пациенток набиралась с 2009 года, мы смогли оценить только одногодичную выживаемость больных в основной и контрольной группах. Одногодичная выживаемость больных с распространенными формами рака яичников в основной и контрольной группах представлена на рисунках 6 и 7.
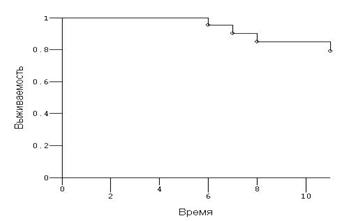
Рис.6. Кривая Каплана-Мейера, оценивающая одногодичную выжи-ваемость больных основной группы – 78,9±2,3%.
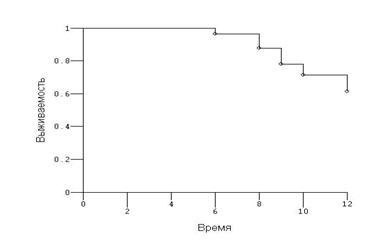
Рис.7. Кривая Каплана-Мейера, оценивающая одногодичную выживаемость больных контрольной группы – 65,2±3,1%.
Одногодичная выживаемость больных распространенными формами рака яичников в основной группе составила 78,9±2,3%, контрольной - 65,2±3,1% (Р=0,408). Таким образом, имеется отчётливая тенденция к увеличению выживаемости у пациенток, которым на протяжении комплексной терапии в схему лечения был включён препарат промисан.
Выводы:
1. Промисан хорошо переносится всеми больными и не увеличивает частоту и тяжесть побочных реакций и осложнений комплексного лечения больных с распространёнными формами рака яичников.
2. После проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы (с промисаном) удалось провести оперативное лечение с оптимальной циторедукцией опухоли и лишь 9 (30,0±7,7%) пациенткам контрольной группы (без промисана), пробных операций в основной группе не было (р<0,01).
3. Клиническими проявлениями прогрессирования заболевания были: в большинстве случаев – это рецидивы в малом тазу в 21,7% случаев у больных основной группы и в 30% у больных контрольной группы; метастазы в забрюшинные лимфатические узлы – в 8,7% в основной группе и 10% в контрольной группе; метастазы в легкие и печень незначительно превалировали у больных основной группы по сравнению с контрольной (4,3%, 8,7% и 3,3%, 6,7% соответственно).
4. Одногодичная выживаемость пациенток, получавших промисан, на 13,7% больше чем у пациенток, которые не получали промисан (78,9% и 65,2% соответственно) Р=0,408.
Литература
- Ашрафян, Л. А. Патогенетичесая профилактика рака репродуктивных органов / Л. А. Ашрафян, В. И. Киселев, Е. Л. Муйжнек // М.: Молодая гвардия, 2009. – 171 с.
- Жорданиа К. И. и др. Клиническая онкогинекология / Под ред. В. П. Козаченко. // Руководство для врачей. – М. Медицина, 2005.
- Максимов С. Я. Практическая онкология / С. Я. Максимов, К. Д. Гусейнов // Т.11, № 3, 2010.
- 5. Киселев В. И., Муйжнек Е. Л. Общие принципы профилактики метастатической болезни и сенсибилизации опухолей / Изд-во «Димитрейд График Групп» // Москва. – 2007.
- 6. Киселев В.И., Ляшенко А. А. Индинол – регулятор пролиферативных процессов в органах репродуктивной системы/ Монография. г. Москва, 2005.
- 7. Киселев В.И., Ляшенко А. А. Молекулярные механизмы регуляции гиперпластических процессов / Монография. Изд-во «Димитрейд График Групп» // Москва. – 2007.
- 8. Опухоли женской репродуктивной системы / В. В. Баринов и др.; под общ. ред. М. И. Давыдова, В. П. Летягина, В. В. Кузнецова. – М.: ООО «Медицинское информационное агентство», 2007. – 376 с.
- 9. Переводчикова, Н.И. Химиотерапия опухолевых заболеваний: краткое руководство / Н.И. Переводчикова. - М., 2004. - 391 с.
- 10.Урманчеева, А.Ф. Вопросы эпидемиологии и диагностики рака яичников/ А.Ф. Урманчеева // Практическая онкогинекология: избранные лекции / под ред. А.Ф. Урманчеевой и др. - СПб., 2008. - С. 320-331.
- 11.Чиссов, В.И. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность) / под ред. В.И. Чиссова и др. - М., 2011. - 259 с.
- 12. Чиссов, В.И. Состояние онкологической помощи населению России в 2009 году / под ред. В.И. Чиссова и др. - М., 2019. - 195 с.
- 13. K?bel M., Kalloger S.E., Boyd N., McKinney S., Mehl E. et al. Ovarian carcinoma subtypes are different diseases: implications for biomarker studies // PLOS Medicine. – 2008. – Vol.5, issue 12. – e232. www.plosmedicine.org
- 14. Gilks C.B., Ionescu D., Kalloger S.E., K?bel M., Irving J. et al. Tumor cell type can reproducibly diagnosed and is of independent prognostic significance in patients with maximally debulked ovarian carcinoma // Human Pathology. – 2008. – Vol.39. – P. 1239-1251.
- 15. Delaying the primary surgical effort for advanced ovarian cancer: a systematic review of neoadjuvant chemotherapy and interval cytoreduction / R.E. Bristow [et al] // Gynecol Oncol. – 2007. – N104. – P. 480 – 490.
- 16. The Role of Cytoreductive/Debulking Surgery in Ovarian Cancer / Mark T. Wakabayashi [et al] // J Natl Compr Canc Netw. – 2008. – Vol. 6, № 8. – P. 803 – 811.
Список сокращений
- ПХТ – полихимиотерапия
- НАПХТ – неоадьювантная полихимиотерапия
- АПХТ – адьювантная полихимиотерапия
- СР – циклофосфан, цисплатин
- УЗИ – ультразвуковое исследование
- КТ – компьютерная томография
- МРТ – магнито-резонанская томография



