Введение
Колоректальный рак (КРР) в настоящее время занимает 3-е место в мире в структуре заболеваемости злокачест- венными опухолями, уступая лишь раку легкого и раку молочной железы. Примерно у половины пациентов на мо- мент постановки диагноза или позже развивается диссе- минация процесса. Еще 30 лет назад единственным дос- тупным для лечения метастатического КРР (МКРР) препа- ратом был 5-фторурацил (5-ФУ), а средняя продолжитель- ность жизни больных МКРР составляла около 12 мес. Новые химиотерапевтические препараты, такие как ирино- текан и оксалиплатин, в сочетании с инфузиями 5-ФУ (режимы FOLFIRI и FOLFOX) позволили увеличить этот показатель до 20 мес. С 1990-х годов арсенал химиотерапевта пополняется новым классом противоопухолевых средств - моноклональными антителами. В настоящее время для лечения МКРР применяются две группы данных препара- тов: угнетающие опухолевый неоангиогенез и блокирующие рецепторы эпидермального фактора роста (EGFR). Моноклональное антитело к сосудистому эндотелиальному фактору роста (VEGF) - бевацизумаб, добавленное к химиотерапии, увеличивает время до прогрессирования и продолжительность жизни по сравнению только с химиотерапией. Другим перспективным направлением является терапия, направленная против EGFR.
EGFR входит в состав семейства трансмембранных ре- цепторов HER, в которое также входят her-2/neu, EGFR3 и EGFR4. Факторами (лигандами), активирующими EGFR, являются трансформирующий фактор роста-а, эпидермальный фактор роста, амфирегулин и эпирегулин. После взаимодействия лиганда с EGFR происходит его гомо или гетеродимеризация, что приводит к аутофосфорилированию ряда тирозинкиназ. Далее сигналы каскадно передаются в ядро клетки, регулируя клеточный рост, пролиферацию, ангиогенез, инвазию и метастазирование.
Среди анти-EGFR-антител в настоящее время доступны два препарата: цетуксимаб и панитумумаб (Вектибикс). Основное их отличие заложено в структуре. Так, цетуксимаб представляет собой химерное моноклональное антитело к EGFR и на 34% состоит из мышиных антител, что может вызывать нежелательную иммунологическую реакцию. Панитумумаб является на 100% человеческим иммуноглобулином G2 (IgG2) и обладает большей аффинностью к EGFR, чем его натуральные лиганды. Меньшая иммуногенность препарата позволила в 3 раза снизить частоту выраженных инфузионных реакций по сравнению с цетуксимабом, а также отказаться от премедикации.
В данной статье будут рассмотрены эффективность и переносимость панитумумаба при терапии МКРР.
Исследования I фазы
Проведены 2 больших исследования I фазы. В одном из них приняли участие 84 пациента с различными резистентными к стандартной терапии опухолями [1]. Часть больных получали препарат в дозе 6 мг/кг каждые 2 нед, другая - 9 мг/кг каждые 3 нед. Среди 11 включенных в исследование больных МКРР отмечены 2 частичные регрессии и 5 стабилизаций. Основной дозозависимой токсичностью была кожная сыпь.
В другом исследовании 96 пациентов получали панитумумаб в дозе 0,01-5 мг/кг еженедельно, 6 мг/кг каждые 2 нед или 9 мг/кг каждые 3 нед [2]. Максимально переносимая доза не была достигнута, основной токсичностью также была кожная сыпь. Среди 39 пациентов МКРР частичные ремиссии зафиксированы у 13%.
Независимо от режима введения фармакокинетика препарата была сходной: концентрации препарата в сыво- ротке не различались, время полужизни составляло 6-8 дней.
Выведение панитумумаба, как и нормальных иммуноглобулинов, осуществляется двумя путями: ретикулоэндотелиальной системой или путем связывания с рецепторами. Не отмечено влияния на фармакокинетику препарата таких параметров, как возраст, пол, раса, функция почек и печени.
В настоящее время наиболее часто применяемой дозой является 6 мг/кг каждые 2 нед. Однако в случае 3-недельных режимов возможна и дозировка 9 мг/кг каждые 3 нед.
Исследования II фазы
Основываясь на обещающей активности панитумумаба в исследованиях I фазы при МКРР, было проведено 3 исследования II фазы. Суммарно в них приняли участие 350 пациентов МКРР, получившие ранее 1-3 линии химиотерапии с включением 5-ФУ, оксалиплатина и/или иринотекана [3-5].
В одном из исследований применялась доза 2,5 мг/кг еженедельно, в двух других - 6 мг/кг каждые 2 нед. Вне зависимости от режима введения эффективность панитумумаба оказалась сходной: частота объективного ответа составила 4-14%, стабилизации - 21-35%. Медиана времени до прогрессирования была около 8 нед, а медиана продолжительности жизни варьировала в пределах 7,4-10,1 мес.
Основной токсичностью была кожная сыпь, отмечен- ная у 95% больных. Реже встречалось поражение ногтей (около 30%) и глаз (8-17%, все степени). Среди других видов токсичности преобладали диарея (около 25%, включая 1-3% III степени) и гипомагнезиемия (около 10%, включая 3% III степени). При этом частота выраженных инфузион- ных реакций III степени не превышала 1%.
Проанализирована эффективность терапии в зависи- мости от уровня экспрессии EGFR, определяемой иммуно-гистохимически. Оказалось, что эффекты одинаково часто регистрировались как при EGFR+, так и EGFR--опухолях. Время до прогрессирования также не различалось.
Рандомизированные исследования III фазы
Монотерапия в сравнении с симптоматической терапией
Первым рандомизированным исследованием панитумумаба, на основании которого он был зарегистрирован в США и Европе, было сравнение его в качестве монотерапии с симптоматической терапией у больных МКРР, полу- чавших ранее фторпиримидины, иринотекан и оксалиплатин. В исследовании участвовали 463 больных с экспрессией EGFR, панитумумаб назначался в дозе 6 мг/кг каждые 2 нед [6]. Основной задачей исследования было улучшение выживаемости до прогрессирования. Назначение панитумумаба достоверно повысило частоту объективных ответов с 0 до 10% (p<0,001), стабилизации заболевания – с 10% до 27% и выживаемость до прогрессирования – с 7,3 нед до 8 нед (p<0,001) по сравнению с аналогичными показателями при симптоматической терапии. Возросла и токсичность: выраженные (III и IV степени) побочные реакции в группе панитумумаба развились у 33% и 2% больных соответственно, тогда как в контрольной группе они наблюдались у 18% и 2%. Кроме типичной кожной сыпи, увеличилась частота диареи (с 11% до 21%, все степени), общей слабости (с 15% до 24%, все степени) и гипомагниемии (с 1% до 36%, все степени). Лишь у 1 больного имела место инфузионная реакция III степени на панитумумаб.
При прогрессировании заболевания 176 (76%) пациентов из группы симптоматической терапии начали терапию панитумумабом (crossover), что, по-видимому, и привело к отсутствию различий в продолжительности жизни. Эффективность панитумумаба у больных «симптоматиче- ской» группы, переведенных на панитумумаб, соответствовала таковой в группе первоначально получавших панитумумаб. Медиана продолжительности жизни в обеих группах составила 6,3 мес. Таким образом, в группе пациентов, уже получивших всю активную химиотерапию, панитумумаб достоверно улучшил выживаемость до прогрессирования и частоту объективных ответов по сравнению с одной симптоматической терапией.
Факторы, предсказывающие эффективность терапии панитумумабом
С целью предсказания эффективности панитумумаба и цетуксимаба исследовали разные молекулярные факторы. На ранних этапах казалось, что наиболее подходящим кандида- том на эту роль является определение экспрессии EGFR на поверхности опухолевых клеток, как это широко используется для определения чувствительности к трастузумабу и гор- монотерапии при раке молочной железы. Однако уже в исследованиях II фазы не было выявлено зависимости между эффективностью панитумумаба и уровнем экспрессии EGFR.
Мутация K-RAS
Ген K-RAS является важным участником в передаче сигналов от рецептора EGFR в ядро клетки. Около 40% аденокарцином толстой кишки имеют его мутацию, в результате ген начинает передавать активирующие сигналы даже при отсутствии стимулирующих сигналов со стороны EGFR. Впервые предсказывающее значение мутации K-RAS было продемонстрировано в упомянутом исследовании III фазы монотерапии панитумумабом в сравнении с сим- птоматической терапией. Оказалось, что при отсутствии мутации K-RAS добавление панитумумаба достоверно увеличивало медиану выживаемости до прогрессирования с 7,3 до 12,3 нед (p<0,001) и частоту объективного ответа с 0 до 17%, а частоту стабилизаций заболевания – с 12% до 34% по сравнению с симптоматической терапией. В то же время наличие мутации K-RAS предсказывало неэффективность терапии панитумумабом, результаты которой не отличались от таковых в группе симптоматической тера- пии (частота объективного ответа 0%, медиана выживаемости до прогрессирования 7,2–7,3 мес) (рис. 1) [7].
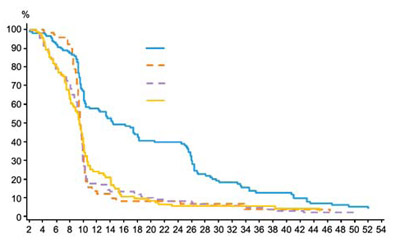
Кроме того, в некоторых исследованиях выявлено нега- тивное влияние цетуксимаба и панитумумаба на эффек- тивность терапии у больных с мутацией гена K-RAS [8, 9]. В настоящее время тестирование на наличие мутации гена K-RAS в 12 и 13 кодонах является обязательным перед назначением анти-EGFR-антител.
Другие молекулярные факторы прогноза
В качестве других молекулярных факторов прогноза в ретроспективных анализах показано негативное значение мутации B-RAF и числа копий гена K-RAS. B-RAF является геном, располагающимся ниже K-RAS в цепочке пере- дачи сигнала от EGFR к ядру. Мутация B-RAF может иметь место лишь при отсутствии мутации K-RAS, что обуслов- ливает резистентность к терапии цетуксимабом и панитумумабом [10].
Увеличение числа копий гена K-RAS – другой фактор, определяющий неэффективность терапии анти-EGFR-антителами [11]. Однако все эти данные требуют подтверждения в проспективных исследованиях перед тем, как рекомендовать их использование в рутинной практике.
Кожная сыпь
Важным клиническим фактором, предсказывающим ответ на анти-EGFR-терапию, является кожная сыпь. Чем выше ее степень, тем лучше результаты терапии. Впервые это было показано для низкомолекулярных ингибиторов тирозинкиназ EGFR (гефитиниб, эрлотиниб) у больных раком легкого.
В исследовании III фазы монотерапии панитумумабом в сравнении с симптоматической терапией была выявлена прямая корреляция между выраженностью сыпи и выживаемостью до прогрессирования [12].
Панитумумаб в комбинации с химиотерапией
2-я линия химиотерапии
Эффективность панитумумаба во 2-й линии химиотерапии была определена в большом рандомизированном исследовании III фазы. В исследовании приняли участие 1083 пациента с прогрессированием заболевания в течение не более 6 мес после завершения 1-й линии химиотерапии [13]. В 1-й линии химиотерапии 100% больных получили фторпиримидины, а около 70% – и оксалиплатин. Основной задачей исследования было улучшение выживаемости до прогрессирования и продолжительности жизни больных без мутации K-RAS. Пациентов рандомизировали на лечение по программе FOLFIRI + панитумумаб 6 мг/кг в 1-й день каждого курса (каждые 2 нед) или на одну химиотерапию FOLFIRI. Лечение продолжалось до прогрессирования или развития токсичности.
Среди 1083 включенных в исследование больных 597 (55%) не имели мутацию K-RAS, и эффективность терапии была оценена в данной субпопуляции. Добавление панитумумаба достоверно улучшило частоту объективного ответа с 10% до 35% и выживаемости до прогрессирования с 3,9 мес до 5,9 мес (относительный риск – HR=0,73; 95% доверительный интервал – 95% ДИ 0,59–0,90; p=0,004). Кро- ме того, наблюдалась тенденция и к улучшению продолжительности жизни с 12,5 мес до 14,5 мес (HR=0,85; 95% ДИ 0,70–1,04; p=0,12), однако не достигшая статистической значимости. У пациентов с мутацией K-RAS добавление панитумумаба не повлияло на результаты терапии, и все показатели эффективности были сходны с таковыми при применении только одного режима FOLFIRI (табл. 1).
Таблица 1. Панитумумаб в комбинации с FOLFIRI во второй линии химиотерапии: эффективность в зависимости от статуса K-RAS
| Показатель | Режим | Количество больных | ОЭ, % | Медиана PFS, мес | Медиана продолжительности больных жизни, мес |
|---|---|---|---|---|---|
| Нет мутации K-RAS | FOLFIRI + панитумумаб | 303 | 35 | 5,9 | 14,5 |
| FOLFIR | 294 | 10 | 3,9; p=0,004 | 12,5; p=0,12 | |
| Есть мутация K-RAS | FOLFIRI + панитумумаб | 238 | 13 | 5,0 | 11,8 |
| FOLFIRI | 248 | 14 | 4,9; р=0,14 | 11,1; p=0,55 |
Примечание. См. здесь и в табл. 2: ОЭ – общий объективный эффект; PFS – выживаемость без прогрессирования.
Ценой улучшения результатов лечения явился рост частоты побочных явлений за счет специфической для панитумумаба токсичности. Так, частота кожной сыпи III–IV степени повысилась с 2% до 37%, диареи – с 9% до 14%, а гипо- магнезиемии – менее чем с 1% до 3%. Тем не менее частота летальных осложнений в обеих группах была одинаковой. Вновь обратила на себя внимание низкая (менее 1%) часто- та инфузионных реакций III–IV степени на панитумумаб.
1-я линия химиотерапии
В этом году были представлены результаты другого рандомизированного исследования – PRIME, в котором срав- нивали комбинацию FOLFOX + панитумумаб 6 мг/кг каж- дые 2 нед c режимом FOFLOX в качестве 1-й линии терапии больных МКРР. В исследовании участвовали 1183 пациента, из которых 656 (55%) не имели мутации K-RAS [8]. Основной задачей исследования было улучшение выживаемости до прогрессирования в зависимости от статуса KRAS. У больных без мутации K-RAS добавление панитумумаба позволило достоверно увеличить медиану выживаемости до прогрессирования с 8,0 мес до 9,6 мес (HR=0,80, 95% ДИ 0,66–0,97; p=0.02). Также отмечена тенденция и к улучшению продолжительности жизни (p=0,16), однако окончательный анализ продолжительности жизни еще преждевременен. Частота объективных ответов увеличилась незначительно – с 48% до 55% (табл. 2).
| Исследование |
Режим | Количество больных | ОЭ, % | Медиана PFS, мес | Медиана продолжительности больных жизни, мес |
|---|---|---|---|---|---|
| 1-я линия | |||||
| PRIME, Douillard, 2009 г. | FOLFOX + панитумумаб | 325 | 55 | 9,6 | Не достигнута |
| FOLFOX | 331 | 48 | 8,0; ОР=0,80; p=0,02 | 18,8; ОР=0,83; p=0,16 | |
| 2-я линия | |||||
| AMG-181, Peeters, 2009 г. | FOLFIRI + панитумумаб | 303 | 35 | 5,9 | 14,5 |
| FOLFIRI | 294 | 10 | 3,9; ОР=0,73; p=0,004 | 12,5; ОР=0,85; p=0,12 | |
| 3-я линия | |||||
| Amado, 2008 г. | Панитумумаб | 124 | 17 | 2,87 | 8,1 |
| симптоматическая терапия | 119 | 0 | 1,7; ОР=0,45; p=0,001 | 7,6; p>0,05 (был crossover) | |
Таблица 2. Панитумумаб при лечении МКРР: результаты рандомизированных исследований (анализ пациентов без мутации K-RAS)
Интересные результаты получены у пациентов с мута- цией K-RAS. Оказалось, что панитумумаб не только не улучшал, но даже ухудшал результаты терапии, по сравне- нию с таковыми при применении одного режима FOLFOX. Выживаемость до прогрессирования снизилась с 8,8 мес до 7,3 мес (p=0,02), а медиана продолжительности жизни – с 18,7 мес до 15,1 мес (p=0,004; рис. 2). Механизм воз- можного негативного влияния панитумумаба у больных с мутацией гена K-RAS не известен.
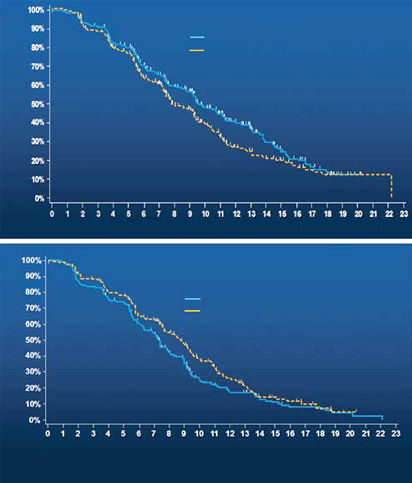
Рис. 2. PFS в зависимости от наличия мутации гена K-RAS:
FOLOX ± панитумумаб в 1-й линии химиотерапии МКРР:
а – отсутствие мутации K-RAS, б – наличие мутации K-RAS.
Таким образом, применение панитумумаба в комбинации с режимами FOLFOX и FOLFIRI в первой и второй линиях химиотерапии позволяет достоверно улучшить частоту объективных ответов и показатели выживаемости до прогрессирования у больных без мутации гена KRAS.
Совместное применение бевацизумаба и анти-EGFR-антител
Бевацизумаб и анти-EGFR-антитела в комбинации с химиотерапией улучшают результаты лечения по сравнению с одной химиотерапией. Обладая разными механизмами действия и отличающимся токсическим профилем, их совместное применение выглядело перспективным. Многоцентровое исследование III фазы PACCE предполагало рандомизацию больных в группы химиотерапия + бева- цизумаб 5 мг/кг или химиотерапия + бевацизумаб 5 мг/кг + панитумумаб 6 мг/кг. В качестве химиотерапии приме- няли как режимы на основе оксалиплатина (823 пациента), так и иринотекана (230). Основной задачей исследования было улучшение выживаемости до прогрессирования в группе с оксалиплатином. Исследование было досрочно приостановлено после планового промежуточного анализа, который показал ухудшение выживаемости до прогрессирования с 11,4 мес до 10,0 мес (HR=1,27; 95% ДИ 1,06–1,52) и продолжительности жизни с 24,5 мес до 19,4 мес в группе панитумумаб + бевацизумаб по сравнению с одним бевацизумабом [14]. Первоначально негативные результаты исследования объясняли большей токсичностью в экспериментальной группе: частота кожной сыпи III–IV степени увеличилась с 1% до 36%, диареи III–IV степени – с 13% до 24%, инфекции III–IV степени – с 10% до 19%. Однако в сходном исследовании CAIRO-2, в котором сравнивали режимы XELOX + бевацизумаб или XELOX + бевацизумаб + цетуксимаб, выживаемость до прогрессирования в группе с цетуксимабом также оказалась ниже [15]. При этом токсичность в обеих группах была сравнимой. По-видимому, существует определенный антагонизм между двумя классами таргетных препаратов, механизм которого еще следует установить.
Имеющиеся данные 2 исследований свидетельствуют о недопустимости одновременного применения бевацизумаба и анти-EGFR антител (панитумумаба и цетуксимаба).
Кожная токсичность панитумумаба: профилактика, лечение
Кожная токсичность является типичной для панитуму- маба и развивается у подавляющего(более 90%) большинства больных, включая 10–12% III–IV степени [8, 13]. Патогенез кожной токсичности не известен. Известно, что высокая экспрессия EGFR наблюдается в кератиноцитах, кожных и волосяных фолликулах. Возможно, что блокирование EGFR приводит к апоптозу в этих клетках. Клинически кожная токсичность представлена (в порядке уменьшения частоты) акнеформной сыпью, сухостью, образованием трещин, паронихий, изменением ногтей. Сыпь обычно появляется в первые 2–4 нед после начала терапии панитумумабом, при продолжении терапии степень ее выраженности часто уменьшается. Специфической терапии не существует. В качестве мер профилактики рекомендуется избегать инсоляции, чаще пользоваться увлажняющими кремами. Топические кортикостероиды эффективны лишь в острой фазе, помогая снять зуд. Длительное их использование может лишь усугубить сухость и вызвать истончение кожи. Выраженная (III–IV степени) кожная токсичность чаще всего ассоциирована с присоединением вторичной бактериальной инфекции и требует местного или системного назначения антибиотиков.
В рандомизированном исследовании II фазы STEPP (Skin Toxicity Evaluation Protocol with Panitumumab) изучали возможность профилактики кожной токсичности посредством раннего назначения терапии (увлажняющее кожу средство, 1% гидрокортизоновая мазь и доксицик- лин внутрь). Пациенты в качестве второй линии химиотерапии получали FOLFIRI + панитумумаб 6 мг/кг каждые 2 нед или иринотекан + панитумумаб 9 мг/кг каждые 3 нед [16]. В исследование были включены 95 больных: часть из них с начала химиотерапии получали описанное выше профилактическое лечение сыпи в течение последующих 6 нед, тогда как у остальных данная терапия начиналась лишь при появлении кожной токсичности. Профилактика кожной токсичности позволила более чем в 2 раза снизить ее частоту (II степень и более: с 62% до 29%) к 6-й не- деле лечения по сравнению с ее отсроченным лечением. Интересно, что кроме кожной токсичности также более чем в 2 раза уменьшилась частота диарей и нейтропений.
Заключение
В лечении МКРР за последнюю пару десятилетий про-изошел значительный прогресс. Кроме появления новых химиотерапевтических препаратов, арсенал химиотера- певта пополнился двумя классами таргетных препаратов – моноклональными антителами, блокирующими неоангиогенез, и EGFR. Одним из представителей последнего является панитумумаб. Панитумумаб представляет собой полностью человеческий IgG2, связывающийся с EGFR. У больных МКРР, получавших ранее оксалиплатин, иринотекан и фторпиримидины, панитумумаб при монотерапии достоверно увеличивает выживаемость до прогрессирования по сравнению с одной симптоматической терапией. В этом же исследовании впервые было показано, что эффект панитумумаба реализуется только у больных без мутации гена K-RAS.
В 2009 г. стали доступны результаты сразу 2 рандомизированных исследований, изучавших роль панитумумаба в комбинации с химиотерапией в 1-й и 2-й линиях МКРР. В обоих исследованиях панитумумаб достоверно увеличил выживаемость до прогрессирования больных без мутации K-RAS. Была также выявлена тенденция и к увеличению продолжительности жизни.
Попытка улучшить результаты лечения МКРР путем совместного применения бевацизумаба и анти-EGFR-антител не увенчалась успехом: в 2 исследованиях показано ухудшение результатов при их одновременном назначении.
В настоящее время панитумумаб для монотерапии заре- гистрирован в Евросоюзе и Российской Федерации у больных МКРР без мутации K-RAS, получавших ранее оксалиплатин, иринотекан и фторпиримидины. Однако, основываясь на результатах успешного применения препарата в 1-й и 2-й линиях, в ближайшее время следует ожидать расширение показаний к его применению.
Авторы: А.А.Трякин, С.А.Тюляндин
Отделение клинической фармакологии и химиотерапии РОНЦ им. Н.Н.Блохина РАМН, Москва
Журнал "Современная онкология №4 2009 г."
Литература
- Stephenson J, Cohn A, Crawford J et al. Administration of panitumumab (Pmab) every two weeks (Q2W) as a 30-min or 60-min infusion: safety and pharmacokinetics (PK) from a phase 1 study in patients with solid tumors. Gastrointestinal Cancers Symposium, Orlando, 2007; Abstr. 368.
- Weiner L, Belldegrun A, Crawford J et al. Updated results from a dose and schedule study of Panitumumab (ABX-EGF) monotherapy in patients with advanced solid malignancies. Clin Cancer Res 2008; 14: 502–8.
- Hecht J, Patnaik A, Berlin J et al. Panitumumab monotherapy in patients with previously treated metastatic colorectal cancer. Cancer 2007; 110: 980–7.
- Hecht R, Mitchell E, Baranda J et al. Panitumumab (Pmab) efficacy in patients (pts) with metastatic colorectal cancer (mCRC) with low or undetectable levels of epidermal growth factor receptor (EGFr): Final efficacy and KRAS analyses. Gastrointestinal Cancers Symposium, Orlando, 2008; Poster 343.
- Yoshino T, Muro K, Doi T et al. Phase 2 study of Panitumumab (Pmab)monotherapy in Japanese patients (pts) with metastatic colorectal cancer (mCRC) after the failure of fluoropyrimidine, irinotecan (CPT- 11) and oxaliplatin (OHP) chemotherapy. Gastrointestinal Cancers Symposium, Orlando, 2008; Abstr. 366.
- Van Cutsem E, Peeters M, Siena S et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658–64.
- Amado R, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 1626–34.
- Douillard J, Siena S, Cassidy J et al. Randomized Phase 3 Study of Panitumumab with FOLFOX4 vs FOLFOX4 Alone as First-line Treatment in Patients with Metastatic Colorectal Cancer: the PRIME Trial. Eur J Cancer 2009; 7(3 suppl): 10LBA.
- Bokemeyer C, Bondarenko I, Hartmann J et al. KRAS status and efficacy of first-line treatment of patients with metastatic colorectal cancer (mCRC) with FOLFOX with or without cetuximab: The OPUS experience. J Clin Oncol 2008; 26: (suppl); abstr 4000.
- Di Nicolantonio F, Martini M, Molinari F et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol 2008; 26: 5705–12.
- Moroni M, Veronese S, Benvenuti S et al. Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6: 279–86.
- Humblet Y, Peeters M, Siena S et al. Association of skin toxicity (ST) severity with clinical outcomes and health-related quality of life (HRQoL) with panitunumab (Pmab). American Society of Clinical Oncology, Chicago, 2007; Abstr. 4038.
- Peeters M, Price T, Hotko Y et al. Randomized phase 3 study of panitumumab with FOLFIRI vs FOLFIRI alone as second-line treatment (tx) in patients (pts) with metastatic colorectal cancer (mCRC). Eur J Cancer 2009; 7(3 suppl): 14LBA.
- Hecht J, Mitchell E, Chidiac T et al. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 2008; 27: 672–80.
- Punt C, Tol J, Rodenburg CJ et al. Randomized phase III study of capecitabine, oxaliplatin, and bevacizumab with or without cetuximab in advanced colorectal cancer (ACC), the CAIRO2 study of the Dutch Colorectal Cancer Group (DCCG). J Clin Oncol 2008; 26 (Suppl); abstr LBA4011. Mitchell E, Lacouture M, Shearer H et al. Final STEPP results of prophylacatic versus reactive skin toxicity (ST) treatment (tx) for panitumumab (pmab)-related ST in patients (pts) with metastatic colorectal cancer (mCRC). J Clin Oncol 2009; 27 (18 suppl); abstr CRA4027.



