Авторы: Е.В. Чигринова, А.И. Павловская ГУ РОНЦ им. Н.Н. Блохина РАМН, Москва
Вовлечение костного мозга (КМ) при периферических нехождкинских лимфомах (НХЛ) является одной из закономерных фаз течения данной группы заболеваний. Основные показания для исследования КМ при НХЛ можно сформулировать следующим образом:
- установление стадии при первичном диагнозе лимфомы;
- оценка динамики процесса на фоне лечения;
- оценка качества полученной ремиссии;
- контроль полноты ремиссии;
- оценка клеточности КМ.
Костномозговая инвазия НХЛ может быть установлена на разных диагностических уровнях, от световой микроскопии до молекулярно-биологических тестов. Для всех типов исследований имеются как достаточно четкие критерии идентификации неопластической лимфоидной популяции, так и объективные ограничения возможностей. Как известно, существуют два основных типа исследуемого материала КМ – аспират (нативная клеточная взвесь) и трепанобиоптат (остеомедуллярный циллиндр). Аспират костного мозга представляет собой клеточную взвесь, позволяющую давать качественно-количественную цитологическую характеристику элементов гемопоэза, а также исследовать иммунофенотип любых нормальных и патологических клеточных субпопуляций методом проточной цитофлюориметрии (ПЦ). Целью трепанобиопсии является комплексное морфологическое исследование, позволяющее помимо собственно гемопоэтической получить информацию о состоянии костной и стромальной тканей. Задачей данной публикации стала попытка доступного изложения сути современных методов исследования КМ на уровне трепанобиоптата.
Трепанобиопсия позволяет наиболее полно оценить строение КМ (наличие или отсутствие в нем лимфоидной инфильтрации, характер ее распределения в КМ и, в частности, расположение лимфоидного инфильтрата по отношению к балкам пластинчатой кости), а также состояние гемопоэза в целом, соотношение жировой и кроветворной тканей, клеточность последней, дать характеристику стромы КМ и костных балок, в частности, распределение и степень выраженности ретикулиновых и коллагеновых волокон, активность остеобластов и остеокластов, ширину межбалочных полостей и т.д. При отсутствии или технической недоступности экстрамедуллярного очага лимфомного поражения, отсутствии патологического лимфоцитоза в аспирате КМ трепанобиоптат КМ может стать единственным источником диагностического материала. К причинам, приводящим к отсутствию лимфомных клеток в аспирате, можно отнести крайне малую численность клеток лейкемического клона, выраженность склеротических изменений в лимфомных очагах, а также экспрессию лимфомными клетками молекул адгезии (МА), которые, с одной стороны, при диссеминации обеспечивают тропность к гемопоэтической ткани и строме КМ, а с другой – определяют прочность межклеточных и клеточно-стромальных контактов [1]. Адгезины, обеспечивающие подобные интратканевые взаимодействия, относятся к трем суперсемействам: иммуноглобулинов – ICAM-1, CD54, интегринов – ?L(CD11a/LFA-1a), ?X(CD11c), ?4(СD49d/ VLA-4), ?1(CD29), ?2(CD18), ?3; а также селектинов – L- селектин (CD62L), Р-селектин (CD62P). Безусловно, это далеко не весь список МА, которые могут определять тип диссеминации НХЛ с органоспецифичной тропностью. Однако в литературе последних лет экспрессия именно этих типов МА ассоциируется с вовлечением КМ и особенностями архитектоники лимфомных очагов в нем [2]. P.J. Lucio и соавт. [3] описали взаимосвязь экспрессии CD11a, CD11c, CD18, CD29, CD44, CD49d, CD54, CD62L с нозологическим вариантом НХЛ и агрессивностью течения. Одним из интересных выводов их работы стало предположение о возможности классификации НХЛ вообще, а также отдельных подтипов внутри каждой нозологии в соответствии с иммунологическим профилем экспрессии МА. E. Horst и соавт. [4] приводят сравнительную оценку уровня экспрессии молекулы CD44 при нормальной В- и Т-дифференцировке и разных стадиях НХЛ. По их данным, экспрессия CD44 соответствует лимфомам с высоким риском лейкемизации, а степень экспрессии этой молекулы увеличивается при прогрессии НХЛ. M.K. Angelopoulou и соавт. [5] также приводят характеристику иммунологического профиля экспрессии МА при разных НХЛ, выделяя CD44 и CD56 как основные факторы риска для поражения КМ при НХЛ.
Таким образом, существуют факторы, которые, с одной стороны, способствуют лейкемизации НХЛ, а с другой – могут быть препятствием для попадания лимфомных клеток в материал аспирата КМ. При данных обстоятельствах трепанобиоптат КМ может быть единственным объектом КМ для исследования лейкемического субстрата.
Установлено, что с большей частотой костный мозг поражается при В-клеточных лимфомах низкой степени злокачественности [6], к которым в соответствии с классификацией опухолей гематопоэтической и лимфоидной тканей ВОЗ [7] относят лимфомы из зрелого вида мелких клеток:
- лимфому из малых лимфоцитов/В-клеточный хронический лимфолейкоз;
- лимфому из клеток мантии;
- нодальный вариант лимфомы маргинальной зоны;
- экстранодальный MALT-типа и маргинальной зоны селезенки;
- фолликулярную лимфому;
- лимфоплазмоцитарную лимфому.
Морфологический анализ
Результативность исследования трепанобиоптата во многом зависит от адекватности биоптата. Последний, по мнению ряда исследователей, должен быть длиной от 2 до 3 см (по крайней мере, не менее 1,5 см) и содержать как минимум 5 или 6 межбалочных полостей [8, 9]. Это связано с тем, что клеточность КМ может быть разной в разных межбалочных полостях. Ее нельзя оценить достоверно по небольшому фрагменту КМ, тем более в тех случаях, когда материал представлен субкортикальной зоной, т.е. зоной, расположенной под кортикальной костью. Эта зона, как правило, малоклеточная, особенно у лиц пожилого возраста. Кроме того, чем больше межбалочных полостей присутствует в биоптате, тем выше вероятность обнаружения очагового поражения КМ. Успешность исследования трепанобиоптата, вне всякого сомнения, зависит также от адекватности всех этапов его обработки: фиксации, декальцинации, заливки и изготовления гистологических срезов. В последние годы предпринимаются попытки методического усовершенствования каждого из этапов обработки КМ, что продиктовано в первую очередь широким внедрением в диагностический процесс методик иммуногистохимического исследования, в частности, с целью определения характера и природы лимфоидной инфильтрации в КМ. Например, предложены методы заливки биоптата в метакрилатные смолы без предварительной декальцинации [10, 11]. Однако одновременно подчеркивается, что эти методы слишком дороги и трудоемки, а хороших результатов, включая и иммуногистохимическое исследование, можно добиться при точном соблюдении всех правил и требований стандартного гистологического метода [11].
Основными показаниями к проведению трепанобиопсии КМ являются:
- подозрение на лимфому;
- установление гистотипа лимфомы;
- определение стадии опухолевого поражения на всех этапах лечебно-диагностического процесса;
- контроль результатов лечения с целью выявления ремиссии, частичной ремиссии, рецидива опухоли и т.д.
Выявление лимфоидной инфильтрации в КМ не является тождественным его лимфомному поражению. В КМ в норме присутствуют лимфоидные клетки, которые могут составлять до 15–20% всей популяции ядросодержащих клеток КМ. Это зрелые клетки и клетки-предшественники Т- и В-лимфоидных линий. Среди зрелых клеток более многочисленны Т-лимфоциты, среди клеток-предшественников преобладают В-линейные клетки. Лимфоидные клетки могут быть расположены интерстициально, между элементами гемопоэза, а могут иметь вид небольших скоплений – лимфоидных узелков. Увеличение числа лимфоидных клеток может быть как абсолютным, так и относительным вследствие сокращения гемопоэза, например, при гипопластических состояниях. Доброкачественные лимфоидные узелки могут быть обнаружены в любом КМ, хотя чаще их находят у лиц пожилого возраста, у женщин, при некоторых гематологических и негематологических заболеваниях, например, при ревматоидных заболеваниях [8], в случаях цитомегаловирусной инфекции, при токсоплазмозе, инфекционном мононуклеозе и других инфекциях, при посттрансфузионном синдроме [12–14] и т.д.
Описаны 4 типа доброкачественных лимфоидных узелков [15, 16]: первый – с зародышевым центром; второй – с четкими границами; третий – с неправильными неровными очертаниями; четвертый – в виде небольших скоплений лимфоидных клеток. В их составе, помимо лимфоидных клеток, обычно находят плазматические клетки, гистиоциты, капилляры, иногда эозинофилы и тучные клетки, а также нежную ретикулиновую сеть. Они могут быть множественными, расположены, как правило, межтрабекулярно. Выявление даже минимальной лимфомной инфильтрации, как известно, является показателем генерализации опухоли и, следовательно, может иметь значение для прогноза и планирования терапии [17]. Поэтому вопросы выяснения природы лимфоидной инфильтрации, дифференциальной диагностики между лимфоидной инфильтрацией доброкачественного характера и лимфомным поражением КМ являются предельно важными, но при этом и одними из самых сложных, и не всегда решаются только методом гистологического исследования, а требуют применения иммуногистохимического, молекулярно-биологического, генетического методов.
Основными гистологическими критериями, используемыми для дифференциальной диагностики лимфомного поражения КМ и доброкачественной лимфоидной инфильтрации, а также для субклассифицирования лимфомы в КМ, являются, во-первых, топографические особенности лимфоидной инфильтрации и, во-вторых, морфологические (ядерно-цитоплазматические) характеристики клеток инфильтрата.
Выделяют 3 основных типа локализации опухолевой лимфоидной инфильтрации в костном мозге: интерстициальный, очаговый и диффузный [8] (рис. 1).
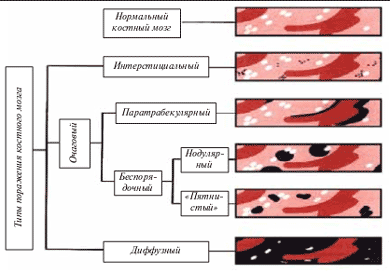
Рис. 1. Схематическое изображение типов поражения КМ при НХЛ [8]
При интерстициальном типе лимфоидные клетки расположены между клетками КМ без нарушения его нормальной архитектуры и гематопоэза (рис. 2).
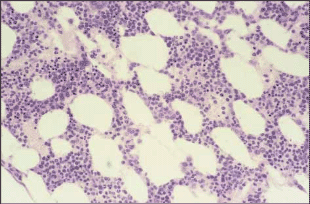
Рис 2. Интерстициальный тип поражения при В-ХЛЛ. Окраска гематоксилином и эозином, ув. 250
При диффузном типе отмечается массивная лимфоидная инфильтрация, заполняющая все или почти все межбалочное пространство с резким сокращением или полным замещением жировой и гематопоэтической тканей. Очаговый тип лимфоидной инфильтрации характеризуется наличием очагов, чаще всего множественных. Очаги могут располагаться межтрабекулярно и/или паратрабекулярно. Паратрабекулярная локализация может иметь вид пласта лимфоидных клеток разной ширины и длины, плотно примыкающего к трабекуле, с явлениями стромального склероза или очага, лежащего на костной трабекуле своим широким основанием (рис. 3).
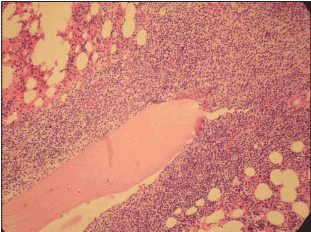
Рис. 3 Паратрабекулярный рост опухолевого инфильтрата при фолликулярной лимфоме. Окраска гематоксилином и эозином, ув. 200
Очаги опухолевой лимфоидной инфильтрации могут располагаться в центральных отделах межтрабекулярной полости, т.е. межтрабекулярно. Они могут иметь вид узелка (рис. 4) с центром (чаще – без него) размножения или очага с неправильными, плохо контурируемыми границами.
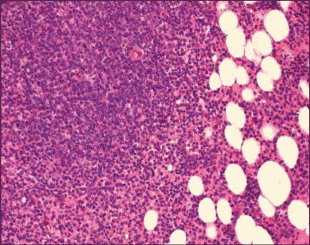
Рис. 4. Очаговое поражение КМ при лимфоме маргинальной зоны. Окраска гематоксилином и эозином, ув. 200.
Очаг крупного размера может прилежать на небольшом протяжении к трабекуле, но такого типа локализация лимфомного очага не является паратрабекулярной. Разновидностью интерстициального типа инфильтрации является интрасинусоидальная локализация опухолевых клеток (рис. 5) [8, 18] .
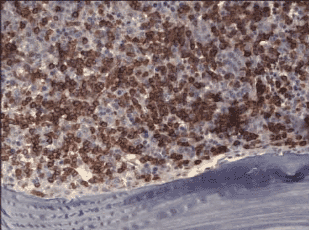
Рис. 5. Интрасинусоидальная локализация опухолевых лимфоцитов. Иммуногистохимия, окраска на CD20
Описан еще один тип лимфомной инфильтрации КМ – моноклеточная дисперсия с присутствием отдельных лимфомных клеток среди элементов гемопоэза в качестве минимально выраженного интерстициального типа.Имеют место сочетания разных типов локализации лимфоидной инфильтрации, составляющие смешанный тип. Например, интерстициально-диффузный, интерстициально-нодулярный, интерсициально-интрасинусоидальный [8, 11]. С учетом топографии лимфомной инфильтрации, морфологических (ядерно-цитоплазматических) характеристик опухолевых клеток и присутствия или отсутствия признаков миелофиброза в зонах поражения разработан алгоритм субклассифицирования лимфом в КМ. Наличие только паратрабекулярной лимфомной инфильтрации позволяет без всякого сомнения говорить о фолликулярной лимфоме. Для фолликулярной лимфомы характерен также смешанный тип инфильтрации, включающий межтрабекулярные очаги, но с непременным присутствием при этом и паратрабекулярной локализации. Очень редким является интерстициальный характер роста лимфомных клеток, почти не встречается диффузный тип. Инфильтраты состоят преимущественно из клеток, похожих на центроциты разного размера, с единичными клетками типа центробластов. Преобладающим по клеточному составу в КМ является тип 1 фолликулярной лимфомы. Нередко картина фолликулярной лимфомы в лимфатическом узле не совпадает по клеточному составу с картиной, наблюдаемой в КМ. Это явление получило название дискордантности. Характерной чертой фолликулярной лимфомы в КМ служит миелофиброз, наблюдаемый в зонах лимфомного поражения без признаков нарушения нормальной архитектуры КМ.
Небольшие фокусы паратрабекулярной инфильтрации могут встречаться при лимфоме зоны мантии и лимфоплазмоцитарной лимфоме, но позволяют исключить лимфому из малых лимфоцитов/В-хронический лимфолейкоз. Для лимфомы зоны мантии типичными являются интерстициальный и очаговый межтрабекулярный типы роста лимфомных клеток [19]. Последние представляют собой смесь однотипных клеток небольшого и среднего размера с неправильными очертаниями ядерной мембраны. Иногда клетки имеют центроцитоидную морфологию, что может усиливать сходство с фолликулярной лимфомой. Однако крупные клетки со строением центробластов или иммунобластов не встречаются. Возможно присутствие гистиоцитов со светлой цитоплазмой без признаков фагоцитоза. Миелофиброз не характерен. Для лимфоплазмоцитарной лимфомы типичными являются интерстициальный, очаговый межтрабекулярный и диффузный типы роста опухолевых клеток. Паратрабекулярная локализация встречается, но крайне редко [18]. Диагностика лимфоплазмоцитарной лимфомы на основании только локализации лимфомного инфильтрата невозможна. Решающую роль играет детальная характеристика клеточного состава, который представлен клетками типа малых лимфоцитов, плазматическими и лимфоплазмоцитоидными клетками, а также небольшим числом иммунобластов, плазмобластов. Частым является миелофиброз, очаговый или диффузный, без нарушения нормальной архитектуры [14].
При интерстициальном и/или диффузном типе инфильтрации с или без формирования очагов, в первую очередь, возникает подозрение на лимфому из малых лимфоцитов/В- клеточный хронический лимфолейкоз. Наличие псевдофолликулов в случаях преимущественно диффузного типа роста опухоли, особенности клеточного состава инфильтрата (малые лимфоциты с округлым ядром, комковатым хроматином) позволяют подтвердить предполагаемый гистотип лимфомы. Миелофиброз для лимфомы из малых лимфоцитов/В-хронического лимфолейкоза не характерен.
Лимфома маргинальной зоны селезенки с циркулирующими виллезными лимфоцитами или без характеризуется очаговой межтрабекулярной или диффузной инфильтрацией опухолевыми клетками КМ. Характерной считают локализацию лимфомных клеток внутри синусов костного мозга [20–22]. Этот тип инфильтрации может встречаться при других вариантах лимфом [18], но в случаях его преобладания диагноз лимфомы маргинальной зоны селезенки можно ставить с большой долей вероятности. Лимфома маргинальной зоны нодального и экстранодального MALT-типа редко вовлекает КМ, но в случаях его поражения имеет место интерстициально-очаговый тип инфильтрации. Очаги крупного размера могут касаться костных трабекул, некоторые из очагов могут быть похожи на лимфоидные фолликулы, иметь центры размножения и широкую маргинальную зону, состоящую из клеток с моноцитоидной морфологией. В клеточном составе присутствуют лимфоидные клетки небольшого и среднего размера с округлыми ядрами, умеренной ширины светлой цитоплазмой, а также разное число плазматических клеток, небольшое количество активированных лимфоидных клеток. Агрессивным вариантам периферических неходжкинских В-клеточных лимфом – диффузной крупноклеточной лимфоме и лимфоме Беркитта – свойствен главным образом диффузный тип роста опухолевых клеток в КМ.
Поражение КМ при периферических Т-клеточных лимфомах встречается реже, чем при периферических В-клеточных [23]. Гистотипами периферических Т-клеточных лимфом являются:
- неспецифицированная;
- ангиоиммунобластная;
- анапластическая крупноклеточная и кожная Т-клеточная лимфома.
Частота поражения КМ при периферических Т-клеточных лимфомах весьма вариабельна, так же как и типы локализации лимфомного субстрата. К особенностям периферических Т-клеточных лимфом относят их способность вызывать выраженные вторичные изменения в виде сосудистой пролиферации, гранулематозной реакции, эозинофилии, миелофиброза и т.д. Одной из важных проблем при верификации поражения КМ периферическими Т-клеточными лимфомами является дифференциальная диагностика с Т-клеточными пролифератами реактивной природы, которые встречаются при опухолевых заболеваниях, например, мелкоклеточных В-клеточных опухолях, классической лимфоме Ходжкина, нодулярном лимфоидном преобладании лимфомы Ходжкина, миелодиспластических синдромах, диффузной крупноклеточной В-клеточной лимфоме, богатой Т-клетками и/или гистиоцитами, а также при неопухолевых состояниях: аутоиммунных заболеваниях, таких как ревматоидный артрит и полимиалгия, ряде вирусных и бактериальных инфекций и т.д. [23].
Интерпретация гистологической информации не всегда бывает простой, и правильный диагноз на основании только гистологического исследования в большинстве случаев невозможен. Требуются тесное сотрудничество между гистопатологом и гематологом, широкое применение дополнительных методов исследования, таких как иммунофенотипирование, а в ряде случаев – молекулярно-биологического и генетического анализа.
Иммунофенотипирование
Трепанобиоптат КМ (остеомедуллярный цилиндр) представляет собой неоднородный по плотности материал: костная составляющая – плотное вещество, гемопоэтическая ткань – рыхлая полужидкая субстанция. Для проведения иммунологических реакций необходимо приготовление ультратонких срезов, требующих приведения всех гистологических компонентов к однородной плотности. Этого можно добиться либо размягчением костных структур, либо уплотнением собственно гемопоэтической ткани. В первом случае проводится декальцинация кости, второй эффект может быть получен при заливке материала в растворы на основе метакрилатных смол или замораживании при низких температурах (до -700С) в особых смесях, при этом оба метода не требуют проведения процесса декальцинации [24, 25]. Замораживание материала трепанобиоптатов идеально для сохранения антигенных детерминант, в то время как использование метакрилатных смол позволяет получать гистологические препараты отменного качества [10, 11]. В настоящее время, как уже было отмечено, наиболее широко в рутинной практике используется метод декальцинации с последующей заливкой материала в парафин. Выбор метода произошел в результате исторической селекции с учетом экономической целесообразности и технической доступности.
Вне зависимости от использованного гистологического протокола заливки материала иммунологическое окрашивание материала производится по единому принципу, в основе которого лежит реакция интересующий антиген – моноклональное антитело. Тип гистологической подготовки трепанобиоптата может влиять только на вид красителя, с помощью которого позитивная реакция может быть прочтена морфологом. Так, для криостатных срезов оптимально использование флюоресцентных красителей, для материала, залитого в парафин или метакрилатные смолы, – хромогенов, видимых на уровне световой микроскопии. Эволюция иммунологических методов исследования материала трепанобиоптатов КМ привела к выбору иммуноферментного метода (иммуногистохимии – ИГХ) на парафиновых срезах КМ в качестве основного. Для наглядности можно привести сравнение всех методик окрашивания (см. таблицу).
Таблица. Сравнение разных методов окрашивания в зависимости от протокола обработки материала трепанобиоптата КМ
| Параметр | Свежезамороженый материал | Парафин | Метакрилатные смолы |
| Сохранность антигенных детерминант | Нативный антиген | Существенное изменение/разрушение структуры антигенов: • метиленовые сшивки при фиксации в формалине; • лизис эпитопов при декальцинации |
Изменение структуры антигенов: метиленовые сшивки при фиксации в формалине |
| Спектр антител | Полный* | Есть исключения | Есть исключения |
| Оптимальный метод визуализации реакции антиген – антитело | Иммунофлюоресценция (возможно сочетание с ИГХ) | ИГХ (возможно сочетание с иммунофлюоресценцией) | ИГХ (возможно сочетание с иммунофлюоресценцией) |
| Возможность архивирования окрашенных препаратов | Нет | Есть | Есть |
| Скорость проведения: (от момента взятия материала до получения результата) | Несколько часов | Несколько суток | Несколько суток |
| Стоимость | Требуются дорогостоящее оборудование – криостат, флюоресцентный микроскоп, меченные флюоресцентными красителями антитела | Стандартное для любой морфологической лаборатории оборудование. Основные затраты – моноклональные антитела и системы визуализации | Требуется специальное оборудование – сверхпрочные ножи для микротома. Метакрилатные смолы – дорогостоящий материал. Обязательно наличие проточно-вытяжной системы (метакрилатные смолы – летучие токсичные вещества) |
| Трудоемкость | + | +++ | +++ |
В лаборатории иммунологии гемопоэза РОНЦ РАМН опробованы все представленные методы. Предпочтение отдано ИГХ в сочетании с иммунофлюоресценцией на парафиновых срезах [26, 27]. Очевидно, что иммунофенотипирование трепанобиоптатов КМ – процесс технически сложный и экономически затратный и поэтому требующий четко сформулированных показаний для проведения.
В целом при НХЛ основными задачами иммунофенотипирования КМ являются:
- выявление неопластической лимфоидной инфильтрации;
- дифференциальный диагноз различных вариантов лимфом;
- дифференциальный диагноз с реактивными процессами.
Приоритет в решении поставленных задач должен быть, безусловно, отдан современной проточной цитофлюориметрии аспирата КМ. Показания для иммуногистохимического исследования трепанобиоптатов КМ при НХЛ являются еще более узкими. Исследование должно проводиться:
- при обнаружении патологической лимфоидной инфильтрации КМ и отсутствии возможности проведения проточной цитофлюориметрии аспирата;
- в случае достоверного отсутствия клеток в аспирате или низкого процента общего числа лимфоцитов при лимфомах, отличающихся высокой частотой поражения КМ;
- в составе комплексного исследования КМ при CD5-негативных вариантах (фолликулярная, все варианты лимфом маргинальной зоны);
- для дифференциальной диагностики реактивных и опухолевых плазмацитозов, при низком проценте плазматических клеток в аспирате;
- во всех случаях при выявлении только в материале трепанобиоптата КМ лимфоидной инфильтрации, подозрительной в отношении опухолевой.
При Т-клеточных НХЛ предпочтение должно также отдаваться ПЦ, поскольку при большинстве лимфом диагностической считается коэкспрессия антигенов. Кроме того, существуют сложности применения антител к ??- и ??-Т-клеточным рецепторам, определяющим клональность неопластических Т-лимфоцитов на парафиновых срезах КМ. Комплексного иммуноморфологического исследования трепанобиоптата из всех Т-линейных НХЛ требует анапластическая крупноклеточная лимфома (АКЛ), поскольку ее отличает своеобразный тип костномозговой инвазии – в виде монодисперсии отдельных клеток между элементами гемопоэза, что может быть определено только иммуногистохимически. Процент лейкемизации данного варианта, по мировым данным, составляет около 30, при этом исследование аспирата КМ, как правило, неинформативно [28–30]. Например, в работе А.И. Слугина [31], посвященной крупноклеточным лимфомам у детей, ни у одного из 18 детей с диагнозом АКЛ, установленным на основании морфоиммунофенотипирования нодальных и экстранодальных очагов поражения, при исследовании аспирата КМ из двух точек поражения КМ не определялось.
M. Fraga и соавт. [32] при рутинном гистологическом исследовании биоптатов КМ обнаружили поражение только у 17% пациентов, а при проведении дополнительного иммуногистохимического окрашивания с применением моноклональных антител к CD30 и эпителиальному мембранному антигену (ЕМА) – уже у 23% больных. Во всех 42 случаях, вошедших в их работу, имела место дисперсия единичных опухолевых элементов между нормальными гемопоэтическими клетками и адипоцитами. Подобные гистологические особенности костномозговой инвазии АКЛ описаны также в работах Y. Sadahira и соавт. [16] и C. Bayle и соавт. [33].
Что касается В-НХЛ, то объективная диагностическая ценность иммунофенотипирования трепанобиоптатов КМ неодинакова для разных вариантов, поэтому основные диагностические возможности метода нагляднее представить в соответствии с нозологиями. Например, В-клеточный лимфолейкоз/лимфома из малых лимфоцитов (В-ХЛЛ/ЛМЛ) и волосатоклеточный лимфолейкоз помимо ярко выраженных иммунофенотипических характеристик обладают высоким потенциалом лейкемизации (>90%), что отражается в стабильном появлении патологического лимфоцитоза в аспирате КМ [7, 8, 14]. Комплексное иммуноморфологическое исследование аспирата с использованием ПЦ можно считать основополагающим, поскольку только ПЦ позволяет при использовании двойного и тройного флюоресцентного мечения оценивать диагностические маркерные коэкспрессии: CD23 и CD5 при В-ХЛЛ/ЛМЛ и CD103 и CD25 при ВКЛ на поверхности CD19 + лимфоцитов [34, 35].
Необходимость проведения трепанобиопсии при развернутой лейкемической картине периферической крови и аспирата КМ окончательно не ясна. Если одни авторы, в литературе более ранних лет, утверждают прогностическое значение разных типов инфильтрации КМ при В-ХЛЛ [36, 37], то другие, позднее, это опровергают [38, 39]. Впоследствии были выделены более надежные признаки биологической агрессивности опухоли, такие как наличие соматических гипермутаций в генах, кодирующих вариабельные участки тяжелых цепей, экспрессия молекулы CD38 и высокий уровень ?2 – микроглобулина [40, 41].
Лимфома из клеток мантии (ЛКМ)
Поражение КМ при ЛКМ встречается примерно у 75–80% пациентов [42–48], причем в отличие от В-ХЛЛ лейкемическая фаза периферической крови встречается только у 50% больных. P.L. Cohen и соавт. [49] описали наибольший процент (93) поражения КМ при лимфоме зоны мантии на материале 46 больных. Подобный результат авторы объяснили исследованием материала строго билатеральной трепанобиопсии у всех больных. Основным методом определения иммунофенотипа лейкемического клона при данной нозологии следует считать ПЦ аспирата, позволяющую определять антиген CD5 на клональных В-лимфоцитах и уровень экспрессии молекулы CD20. Однако на настоящий момент накоплено достаточно описаний случаев этой лимфомы с абберантным профилем экспрессии иммунологических маркеров: с отсутствием экспрессии CD5 при положительной экспрессии CD23 [50], коэкспрессией CD5 и CD23 [51], CD5 и CD10 [42, 44], CD10 при отсутствии CD5 [52].Кроме того, основным патогномоничным признаком лимфомы, в соответствии с классификацией ВОЗ (2001), является гиперэкспрессия циклина D1, ассоциированная с транслокацией (11;14), затрагивающей локусы генов, кодирующих тяжелые цепи иммуноглобулинов на хромосоме 14 и локус bcl-1(сyclin D1) на хромосоме 11 [53–57]. Считается, что данное генетическое событие играет основную роль в патогенезе развития лимфомы зоны мантии, так как гиперэкспрессия циклина D1 (белка – регулятора клеточного цикла) блокирует клетку на границе перехода фаз G1? S. Циклин Д1 относится к белкам, экспрессируемым на ядерной мембране, поэтому единственным способом его определения на сегодняшний день является метод иммуногистохимии [58] (рис. 6).
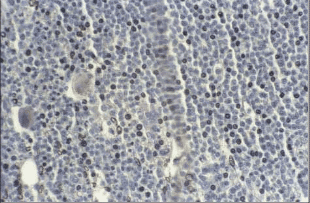
Рис. 6. Ядерная экспрессия циклина Д1 клетками костномозгового субстрата лимфомы из клеток мантии. Иммуногистохимия, ув. 250
Таким образом, можно сказать, что первичное определение иммунофенотипа лейкемического клона при ЛКМ наиболее удобно с использованием ПЦ, но окончательная идентификация диагноза требует проведения иммуногистохимического исследования трепанобиоптата КМ.
Фолликулярная лимфома (ФЛ)
По статистическим данным, вовлечение КМ при ФЛ определяется в 40–60% случаев [59, 60], причем циркуляция опухолевых клеток в периферической крови определяется меньше чем у трети больных [8].
Характерная для ФЛ выраженность склеротических изменений в КМ, а также, вероятно, профиль экспрессии молекул адгезии достаточно часто препятствуют попаданию неопластических клеток в аспират [61–63], поэтому основным методом исследования КМ при известном иммунофенотипе экстрамедуллярной опухоли можно считать гистологию трепанобиоптата. Существование «золотого диагностического стандарта» при ФЛ – паратрабекулярной локализации лимфомного субстрата с центроцитарно-центробластным составом – позволяет морфологу ограничиться уровнем стандартного исследования КМ без применения иммуногистохимического окрашивания.
Иммуногистохимическое исследование при ФЛ требуется для определения минимальной резидуальной инфильтрации КМ при оценке полноты ремиссии [64]. Однако при минимальном количестве В-клеток оценка их природы находится уже за рамками возможностей ИГХ и может быть осуществлена только на основании определения клональной реаранжировки генов иммуноглобулинов или патогномоничной транслокации t(14;18).
Лимфомы маргинальной зоны (ЛМЗ)
В классификации ВОЗ (2001) выделяется 3 основных типа лимфом, происходящих из клеток маргинальной зоны мантии лимфоидных фолликулов или периартериолярных лимфоидных муфт. Это – ЛМЗ селезенки, нодальный вариант ЛМЗ, а также вариант, ассоциированный со слизистыми (MALT).
При ЛМЗ селезенки, по разным данным, поражение КМ встречается наиболее часто – в 67–100% случаев [65–68], при MALT-лимфомах примерно в 20% [65, 69, 70]. Вовлечение КМ при нодальном варианте считается казуистикой, что, однако, может быть объяснено редкостью самой нозологии [12, 71, 72]. На этапе иммунофенотипирования диагноз ЛМЗ устанавливается скорее методом исключения, так как типичных иммунологических маркерных ассоциаций не определено. Характерна экспрессия пан-В-линейных антигенов при отсутствии коэкспрессии молекул CD5, CD23, CD10 [1, 73–77]. Для дифференциальной диагностики внутри группы ЛМЗ может быть полезным учет некоторых различий в экспрессии поверхностных иммуноглобулинов. Так, для ЛМЗ селезенки характерна коэкспрессия молекул IgM+, IgD+, в то время как для нодального варианта – только молекулы IgM в отсутствие IgD- [7, 78]. В данной работе основное внимание хотелось бы уделить варианту ЛМЗ селезенки, обладающему наибольшей тропностью к гемопоэтической ткани. Следует отметить, что у ряда пациентов с ЛМЗ селезенки существуют объективные сложности проведения спленэктомии, поэтому диагностическая нагрузка часто ложится на доступный лейкемический субстрат лимфомы.
Патологический лимфоцитоз аспирата КМ при ЛМЗ селезенки позволяет изучить фенотип лимфомных элементов цитометрически и цитогенетически [8, 79]. Так как эта лимфома не имеет достаточно типичных иммунологических и цитогенетических признаков (делеция хромосомы 7 встречается менее чем в 40% случаев, трисомия хромосомы 3 – менее чем в 17%), для подтверждения диагноза полезна любая дополнительная диагностическая информация, например, определение специфического типа роста лимфомы в трепанобиоптате КМ (ВОЗ). Для ЛМЗ селезенки описано два патогномоничных гистологических типа роста – интрасинусоидальный и нодулярный [8, 14]. При первом типе определение опухолевых «сладжей» внутри сосудов микроциркулярного русла при исследовании стандартно окрашенных срезов трепанобиопатов КМ не всегда возможно – только при использовании иммуногистохимического окрашивания с применением моноклональных антител к пан-В-клеточным маркерам (рис. 7) [27].
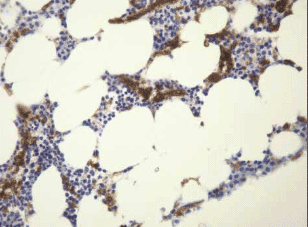
Рис. 7. Интрасинусоидальная локализация «сладжей» опухолевых клеток при ЛМЗ селезенки. Иммуногистохимия, окраска на CD20, ув. 200
Патологические лимфоциты, окрашенные хромогеном коричневого цвета (DAB), формируют линейные структуры по ходу «забитых» ими синусов (микрососудов) КМ Нодулярный тип считается вторым по частоте встречаемости при ЛМЗ селезенки. Его отличают межтрабекулярное расположение, сохранение резидуальных герминогенных центров (вариабельный признак) и выраженная зональность [8, 14, 80]. Указанная ассоциация морфологических признаков определяет сходство патологических нодулей с реактивными лимфоидными фолликулами, поэтому очевидно, что проведение иммуногистохимического исследования трепанобиоптатов КМ при нодальном типе лимфомной инфильтрации при ЛМЗ селезенки также обязательно, и в задачи исследования, помимо проведения дифференциальной диагностики с другими вариантами периферических В-клеточных мелкоклеточных лимфом, входит исключение реактивной природы лимфоидной инфильтрации. Дополнительным признаком неопластической природы лимфомных инфильтратов считается формирование сети фолликулярных дендритных клеток, позитивных по CD21, CD23 и CD35, что нехарактерно для инфильтратов при других вариантах В-НХЛ, а также для реактивных нодулей (рис. 8) [14, 80, 81].
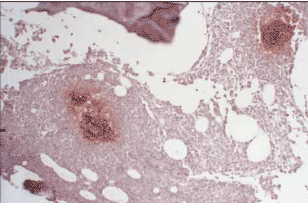
Рис. 8. Сеть фолликулярных дендритных клеток в лимфомных нодулях при ЛМЗС. Иммуногистохимия, окраска на CD21
Лейкемизация MALT-ом, как уже сообщалось, встречается довольно редко [65, 69, 70]. Однако при этих лимфомах могут определяться достаточно плотные Т-клеточные реактивные лимфоидные инфильтраты. Определение природы этих инфильтратов с исключением специфического поражения КМ, лежащего в основе правильного стадирования MALT-ом, также возможно только при иммунофенотипировании [82].
Плазмоклеточные В-НХЛ
Иммуногистохимия трепанобиоптатов КМ представляется замечательным дифференциально-диагностическим тестом при низком проценте плазматических клеток в аспирате КМ у пациентов с парапротеинемией при подозрении на инициальную стадию множественной миеломы (ММ) или контроле минимальной резидуальной болезни при ММ у леченых больных. Оптимальной по информативности можно считать комбинацию иммуноферментного и иммунофлюоресцентного методов на материале трепанобиоптатов КМ (рис. 9) [27, 83]. Иммуногистохимия позволяет определить количество, локализацию и цитологические особенности плазматических клеток. Применение меченного двойной флюоресцентной меткой антитела к легким цепям иммуноглобулинов ? и ? позволяет определить моно- или поликлоновость плазмоцитов в одном поле зрения.
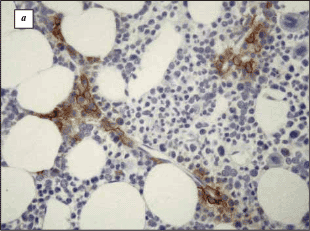
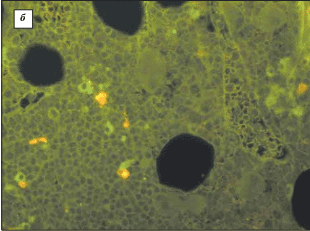
Рис. 9. Реактивный плазмоцитоз. а – иммуногистохимическая окраска на CD138 (синдекан-1); б – иммунофлюоресцентное окрашивание комбинированным меченым антителом ? (зеленое свечение)/? (желтое свечение)
На рис. 9, а хорошо видно, что плазматические клетки, окрашенные коричневым хромогеном, имеют зрелый облик, в них отсутствует ядерная атипия и они расположены перикапиллярно (вдоль синуса). Все признаки наиболее характерны для реактивного плазмоцитоза. На рис. 9, б – в темном поле флюоресцентного микроскопа соотношение плазматических клеток, несущих ?- и ?- цепи иммуноглобулинов, примерно одинаковое (есть небольшое преобладание ?+), т.е. клетки не клональны. Диагноз множественной миеломы исключен.
Агрессивные В-НХЛ: диффузная В-клеточная крупноклеточная лимфома (ДВКЛ) и лимфома Беркитта (ЛБ)
Определение поражения КМ при данных вариантах, имеющих характерную морфологию, представляется достаточно простым и в случаях известного иммунофенотипа экстрамедуллярного компонента может быть ограничено только морфологическим исследованием трепанобиоптата или аспирата КМ. Особый интерес представляет изучение дискордантных мелкоклеточных лимфоидных инфильтратов в КМ при ряде В-НХЛ, в частности, при ДВКЛ и ЛБ. В современной литературе явление дискордантных гистологических ситуаций при ДВКЛ обсуждается довольно редко. Суммируя весь доступный литературный материал, можно выделить три основные причины дискордантности [17, 84]:
- трансформация в более агрессивный вариант (крупноклеточную НХЛ). Наиболее характерно для ФЛ и В-ХЛЛ (синдром Рихтера) и представляет собой морфологическое проявление опухолевой прогрессии;
- реактивный процесс. Мелкоклеточные инфильтраты в КМ, в отличие от экстрамедуллярной ДВКЛ, имеют Т-клеточную природу с разным соотношением CD4+/CD8+-популяций;
- истинная биклональность. Одновременное сосуществование двух лимфопролиферативных процессов с разными иммуноморфологическими и молекулярно-биологическими клональными особенностями. Подобные первично-множественные процессы называются также композитными.
В работе, проведенной в лаборатории иммунологии гемопоэза РОНЦ РАМН, при иммунологическом изучении дискордантных лимфоидных мелкоклеточных инфильтратов у пациентов с ДВКЛ (20 больных) были получены достаточно интересные результаты. Во всех случаях лимфоидные инфильтраты оказались представлены реактивными Т-клетками. В некоторых наблюдениях при иммуногистохимическом исследовании среди Т-компонента определялись крупные В-клетки с признаками явной атипии, подобные центробластам и иммунобластам, что было расценено как начальные признаки костномозговой инвазии ДВКЛ. В этих случаях иммунологическая картина КМ соответствовала варианту ДВКЛ, богатой Т-клетками (рис. 10), при том что экстрамедуллярная опухоль у всех пациентов имела вид классической ДВКЛ.
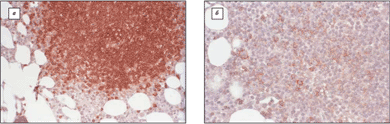
Рис. 10. ИГХ дискордантной мелкоклеточной лимфоидной инфильтрации в КМ больного экстранодальной ДВКЛ. а – окрашивание на CD3 (Т-клеточный компонент); б – окрашивание на CD20 (крупные дискретные анаплазированные В-клетки)
При всестороннем анализе особенностей клинического течения исследованной группы было определено, что тенденция к образованию Т-клеточных скоплений встречалась, в основном, у больных с первичной экстранодальной локализацией ДВКЛ. У пациентов с первичными нодальными формами в КМ выявлялась типичная бластная диффузная инфильтрация, соответствующая экстрамедуллярному компоненту ДВКЛ, а Т-клеточный реактивный компонент был представлен немногочисленными разрозненными клетками (рис. 11).
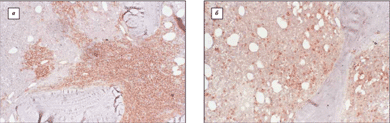
Рис. 11. Иммуногистохимическое исследование лейкемического субстрата КМ при первичной нодальной ДВКЛ. а – окраска на СD20: диффузный рост опухоли крупноклеточного состава; б – окраска на CD3: разрозненные немногочисленные Т-клетки. Ув. 200
Дискордантная мелкоклеточная лимфомная инфильтрация была обнаружена нами и при ЛБ – при иммуногистохимическом окрашивании трепанобиоптата КМ она также оказалась представлена Т-реактивным компонентом (рис. 12). ЛБ у пациента возникла на фоне ВИЧ-инфекции, и Т-клеточная инфильтрация является, вероятно, синцитиальной структурой, характерной для болезни.
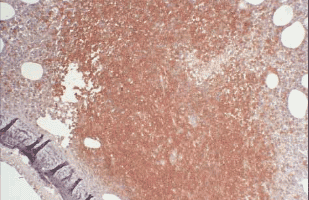
Рис. 12. Дискордантная мелкоклеточная лимфоидная инфильтрация КМ при ЛБ. ИГХ, окрашивание на CD3
На примере дискордантных ситуаций было показано, что иммунофенотипирование трепанобиоптатов КМ помимо чисто практической ценности может представлять научно-исследовательский интерес. Например, определение реактивной Т-клеточной природы мелкоклеточных лимфоидных инфильтратов у пациентов с первичной экстранодальной локализацией ДВКЛ может свидетельствовать о высокой иммуногенности этой формы лимфомы по сравнению с первичной нодальной. Дальнейшее изучение субпопуляционного состава реактивного Т-компонента, а также сопоставление иммунофенотипа двух форм ДВКЛ с разной иммуногенностью может пролить свет на особенности механизмов противоопухолевого иммунитета при лимфомах и гемобластозах вообще.
ИГХ, как любой другой метод, имеет, безусловно, свои ограничения. Например, смешанно-клеточные (Т- и В-клеточные) лимфоидные нодули при периферических В-НХЛ ранее безоговорочно воспринимались как реактивные, однако с развитием молекулярно-биологических методов стало возможным оценивать отдельно взятый В-клеточный компонент. Вследствие этого появилось множество публикаций, посвященных ретроспективному анализу архивного материала трепанобиопсий, в которых авторы доказывали клональную природу В-клеток, выделенных из «реактивных» инфильтратов с помощью полимеразно-цепной реакции (ПЦР) [85, 86]. Действительно, по сравнению с иммунофенотипированием молекулярная диагностика, в частности ПЦР, является более точной, позволяет оценивать минимальное количество лимфоидных элементов, что определяет особенности ее применения – для диагностики минимальной инфильтрации КМ при стадировании в начале болезни и для контроля ремиссии.
Таким образом, можно сказать, что исследование материала трепанобиопата КМ с применением современных методов при большинстве НХЛ является обязательным тестом, позволяющим получить важную дополнительную диагностическую информацию, способную критически повлиять на планирование лечебной тактики. Наиболее достоверным следует считать комплексное иммуноморфологическое исследование аспирата и трепанобиоптата КМ (с применением метода ПЦ для аспирата КМ), установление иммунофенотипа экстрамедуллярного компонента опухоли (при его наличии) [27, 83, 87–90]. В лаборатории иммунологии гемопоэза и отделе патологической анатомии опухолей ГУ РОНЦ им Н.Н. Блохина РАМН разработан комплексный подход к диагностике, включающий детальное гистологическое изучение первичного субстрата НХЛ по парафиновым блокам с подробной иммуногистохимией по свежему материалу (криостатные срезы), цитохимическую и иммуноморфологическую оценку аспиратов КМ, дополненную ИГХ трепанобиоптатов [91].
Материал взят из журнала "Онкогематология", №1-2, 2006.
Рекомендуемая литература
1. Pawade J., Wilkins B.S., Wright D.H. Low- grade B-cell lymphomas of the splenic marginal zone: a clinicopathological and immunohistochemical study of 14 cases.Histopathology 1995;27:129–37.
2. Kimby E., Rincon J., Patarroyo M., Mellstedt H. Expression of adhesion molecules CD11/CD18 (Leu-CAMs, beta 2-integrins), CD54 (ICAM-1) and CD58 (LFA-3) in B-chronic lymphocytic leukemia. Leuk Lymphoma 1994;3(4):297–306.
3. Lucio P.J., Faria M.T., Pinto A.M. et al. Expression of adhesion molecules in chronic B-cell lymphoproliferative disorders. Haematologica 1998;83(2):104–11.
4. Horst E., Meijer C.J., Radaskiewicz T. et al. Expression of a human homing receptor (CD44) in lymphoid malignancies and related stages of lymphoid development. Leukemia 1990;4(5):383–9.
5. Angelopoulou M.K., Kontopidou F.N., Pangalis G.A. Adhesion molecules in B-chronic lymphoproliferative disorders. Semin Hematol 1999;36(2):178–97.
6. Thaler J., Dietze O., Denz H. et al. Bone marrow diagnosis in lymphoproliferative disorders: comparison of results obtained from conventional histomorphology and immunohistology. Histopathology 1991;18(6):495–504.
7. Harris N., Jaffe E.S., Diebold J. et al. World Health Organisation classification of neoplastic diseases of the hematopoietic and lymphoid tissues. Report of the Clinical Advisory Committee meeting, Airlie House, Virginia, November 1997. J Clin Oncol 1999;17(12):3835–49.
8. Bain B.J. et al. Bone marrow pathology. L., Blackwell Science; 2001.
9. Parveen T. Bone marrow procedure, examination and reporting. In: Pathology of bone marrow and blood cells. Farhi D.C. et al. (eds.) Lippincott, Wiliams and Wiliams; 2004. p. 12–22.
10. Bernhards J., Weitzel B., Werner M. et al. A new histological embedding method by low-temperature polymerisation of methyl methacrylate allowing immuno- and enzyme histochemical studies on semi-thin sections of undecalcified bone marrow biopsies. Histochemistry 1992;98(3):145–54.
11. Kreft A., Busche G., Bernhards J., Georgii A. Immunophenotype of hairy-cell leukaemia after cold polymerization of methyl-methacrylate embeddings from 50 diagnostic bone marrow biopsies. Histopathology 1997;30(2):145–51.
12. Nathawani B.N., Anderson J.R., Armitage J.O. et al. Marginal zone B-cell lymphoma: a clinical comparison of nodal and mucosa- associated lymphoid tissue types. J Clin Oncol 1999;17:2486–92.
13. Hamblin T.J., Davis Z., Gardiner A. et al. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999;94(6):1848–54.
14. Feller A.C., Diebold J. Histopathology of nodal and extranodal non-Hodgkin's lymphoma. Third, Completely Revised and Updated Edition. Berlin, NY, Springer-Verlag; 2004.
15. Hashimoto M., Masanori H. et al. Lymphoid nodules in human bone marrow. Acta Pathol Jap 1957;7:33–52.
16. Sadahira Y., Hata S., Sugihara T., Manabe T. Bone marrow involvement in NPM-ALK-positive lymphoma: report of two cases. Pathol Res Pract 1999;195(9):657–61.
17. Krober S.M., Horny H.P., Greschniok A., Kaiserling E. Reactive and neoplastic lymphocytes in human bone marrow: morphological, immunohistological and molecular biological investigation on biopsy speciment. J Clin Pathol 1999;52:521–6.
18. Arber D.A., George T.I. Bone marrow biopsy involvement by Non-Hodgkin’s lymphoma. Frequency of lymphoma types, patterns, blood involvement, and discordance with other sites in 450 speciments. Am J Surg Pathol 2005;29:1549–57.
19. Wasman J., Rosenthal N., Farhi D. Mantle cell lymphoma: morfologic findings and bone marrow involvement. Am J Clin Pathol 1996;106:196–200.
20. Audouin J., Le Tourne A., Molina T. et al. Patterns of bone marrow involvement in 58 patients presenting primary splenic marginal zone lymphoma with or without circulating villous lymphocytes. Br J Haematol 2003;122:404–21.
21. Franco V., Florena A.M., Campesi G. Intrasinusiodal bone marrow infiltration: a possible hallmark of splenic lymphoma.Histopathology 1996;29:571–5.
22. Kent S.A., Variakojis D., Peterson L.C. Comparative study of marginal zone lymphoma involving bone marrow. Am J Clin Pathol 2002;117:698–708.
23. Dogan A., Morice W.G. Bone marrow histopathology in peripherall T-cell lymphomas. Br J Haematol 2004;127:140–57.
24. Cheong S.K., Lim Y.C. Frozen bone marrow trephine biopsy-a technical evaluation. Malays J Pathol 1990;12(1):51–6.
25. Falini B., Mason D.Y., Stein H. et al. The immunohistological analysis of undecalcified human bone marrow trephine biopsies. Technical and diagnostic aspects. Haematologica 1984;69(3):346–76.
26. Чигринова Е.В. Возможности типирования трепанобиоптатов костного мозга при неходжкинских лимфомах. Иммунология гемопоэза. М., Издательская группа ГУ РОНЦ им. Н.Н. Блохина РАМН; 2004. с. 103–9.
27. Чигринова Е.В., Павловская А.И., Тупицын Н.Н. Роль иммунофенотипирования в диагностике опухолевого поражения костного мозга при В-клеточных неходжкинских лимфомах. Иммунология гемопоэза. М., Издательская группа ГУ РОНЦ им. Н.Н. Блохина РАМН; 2006. с. 91–117.
28. Agnarsson B.A., Kadin M.E. Ki-1 positive large cell lymphoma. A morphologic and immunologic study of 19 cases. Am J Surg Pathol 1988;12(4):264–74.
29. Chott A., Kaserer K., Augustin I. et al. Ki-1-positive large cell lymphoma. A clinicopathologic study of 41 cases. Am J Surg Pathol 1990;14(5):439–48.
30. Wong K.F., Chang J.K.C., Ng C.S. et al. Anaplastic large Ki-1 lymphoma involving bone marrow: marrow findings and association with reactive hemophagocytosis Am J Hematol 1991;37:112–9.
31. Слугин А.И. Крупноклеточные лимфомы у детей (клиника, диагностика, лечение). Автореф. дис. … канд. мед. наук. М., 2002.
32. Fraga M., Brousset P., Schlaifer D. et al. Bone marrow involvement in anaplastic large cell lymphoma. Immunohistochemical detection of minimal disease and its prognostic significance. Am J Clin Pathol 1995;103(1):82–9.
33. Bayle C., Charpentier A., Duchayne E. et al. Leukemic presentation of small cell variant anaplastic large cell lymphoma: report of four cases. Br J Haematol 1999;104(4):680–8.
34. Тупицын Н.Н. Иммунодиагностика гемобластозов. Клиническая онкогематология. М., Медицина; 2001. с. 124–45.
35. Тупицын Н.Н. Иммунологическая диагностика лимфом. Руководство по иммуногистохимической диагностике опухолей человека. М., Титул, 2004. с. 246–73.
36. Geisler C., Ralfkaier E., Hansen M.M. et al. The bone histological pattern has independent prognostic value in early stage chronic lymphocytic leukemia. Br J Haematol 1986;62:47–54.
37. Rozmann C., Montserrat E., Rodriguez-Fernandez J.M. et al. Bone marrow histologic pattern- the best single prognostic parameter in chronic lymphocytic leukemia: a multivariate survival analysis. Blood 1984;64:642–8.
38. Mauro F.R., De Rossi G., Burgio V.L. et al. Prognostic value of bone marrow histology in chronic lymphocytic leukemia. A study of 335 untreated cases from a single institution. Haematologica 1994;79(4):334–41.
39. Geisler C.H., Hou-Jensen K., Jensen O.M. et al. The bone-marrow infiltration pattern in B-cell chronic lymphocytic leukemia Eur J Haematol 1996;57(4):292–300.
40. Keating M.J. Chronic lymphocytic leukemia. Semin Oncol 1999;26:107–14.
41. Donher H., Stilgenbauer S., Benner A. et al. Genomic abberation and survaival in chronic lymphocytic leukemia. N Eng J Med 2000;103:472–8.
42. Argatoff L.H., Connors J.M., Klasa R.J. et al. Mantle cell lymphoma: a clinicopathological study of 80 cases. Blood 1997;89:2067–78.
43. Berger F., Felman P., Sonet A. et al. Nonfollicular small B-cell lymhpomas: A geterogeneous group of patients with distinct clinical features and outcome. Blood 1994;83:2829–935.
44. Duggan M.J., Weisenburger D.D., Ye Y.L. et al. Mantle zone lymphoma. A clinicopathologic study of 22 cases. Cancer 1990;66:522–9.
45. Fisher R.I. Mantle-cell lymphoma: Classification and therapeutic implications. Ann Oncol 1996;7(6):35–9. 46. Jaffe E.S., Bookman M.A., Longo D.L. Lymphocytic lymphoma of intermediate differentiation- mantle zone lymphoma: a distinct subtype of B-cell lymphoma. Hum Pathol 1987;18:877–80.
47. Norton A.J., Matthews J., Pappa V. et al. Mantle cell lymphoma: natural history defined in a serially biopsied population over a 20-year period. Ann Oncol 1995;6(3):249–56.
48. Perry D.A., Bast M.A., Armitage J.O., Weisenburger D.D. Diffuse intermediate lymphocytic lymphoma. A clinicopathologic study and comparision with small lymphocytic lymphoma and diffuse small cleaved cell lymphoma. Cancer 1990;66:1995–2000.
49. Cohen P.L., Kurtin P.J., Donovan K.A., Hanson C.A. Bone marrow and peripheral blood involvement in mantle cell lymphoma. Br J Haemat 1998;101:302–10.
50. Wohlschlaeger C.H., Lange K., Merz H., Feller F.C. Abberant immunophenotypes of mantle cell lymhpomas. Leukemia Lymphoma 2003;44(2):269–73.
51. Nelson B.P., Variakojis D., Peterson M.D. Leukemic Phase of B-cell lymphomas mimicking chronic lymphocytic leukemia and variants at presentation. Mod Pathol 2002;15(11):1111–20.
52. Morice W.G., Hodnefield J.M., Kurtin P.J., Hanson C.A. An unusual case of leukemic mantle cell lymphoma with a blastoid component showing loss of CD5 and aberrant expression of CD10. Am J Clin Pathol 2004;122(1):122–7.
53. Rozenberg C., Wong E., Petty E. et al. PRAD1, a candidate BCL1 oncogene: mapping and expression in centrocytic lymphoma. Proc Natl Acad Sci USA 1991;88:9638–42.
54. Chen C.C., Raikow R.B., Sonmez-Alpan E., Swerdlow S.H. Classification of small B-cell lymphoid neoplasms using a paraffin section immunohistochemical panel. Appl Immunohistochem Mol Morphol 2000;8(1):1–11.
55. Williams M., Westermann C., Swerdlow S. Genotypic characterization of centrocytic lymphoma: frequent rearrangement of the chromosome 11 bcl-1 locus. Blood 1990;76:1387–91.
56. Wiliams M.E., Swerdlow S.H., Rosenberg C.L., Arnold A. Chromosome 11 translocation breakpoint at the PRAD1/Cyclin D1 gene locus in centrocytic lymphoma. Leukemia 1993;7:241–5.
57. Rimokh R., Berger F., Delsol G. et al. Rearrangement and overexpression of the BCL-1/PRAD gene in intermediate lymphocytic lymphoma and t(11q13)- bearing leukemias. Blood 1993;81:3063.
58. Vasef M.A., Medeiros L.J., Koo S. et al. Cyclin D1 immunohistohemical staining is useful in distinguishing mantle cell lymphoma from other low-grade B-cell neoplasms in bone marrow. Am J Clin Pathol 1991;108:302–7.
59. Mazza P., Gherlinzoni F., Kemna G. et al. Clinicopathological study on non-Hodgkin's lymphomas. Haematologica 1987;72:351–7.
60. Dick F., Bloomfield C.D., Brunning R.D. Incidence cytology, and histopatology of non- Hodgkin's lymphoma in the bone marrow. Cancer 1974;33:1382–98.
61. Bain B.J. Bone marrow trephine biopsy. J Clin Pathol 2001;54:737–42.
62. Lambertenghi-Deliliers G., Annaloro C., Soligo D. et al. Incidence and histological features of bone marrow involvement in malignant lymphomas. Ann Hematol 1992;65(2):61–5.
63. Thiele J., Langohr J., Skorupka M., Fischer R. Reticulin fibre content of bone marrow infiltrates of malignant non-Hodgkin's lymphomas (B-cell type, low malignancy)- a morfometric evalution before and after therapy. Virchows Arch A Pathol Anat Histopathol 1990;417:485–92.
64. Osborne B.M., Butler J.J. Hypocellular paratrabecular foci of treated small cleaved cell lymphoma in bone marrow biopsy. Am J Surg Pathol 1989;13:382–8.
65. Dierlamm J., Pittaluga S., Wlodarska I. et al. Marginal zone b-cell lymphomas of differentes sites share similar cytogenetic and morphologic features. Blood 1996;87:299–307.
66. Hammer R.D., Glick A.D., Greer J.P. et al. Splenic marginal zone lymphoma. A distinct B-cell neoplasm. Am J Surg Pathol 1996;20:613–26.
67. Melo J.V., Hegde U., Parreira A. et al. Splenic B cell lymphoma with circulating villous lymphocytes: differential diagnosis of B cell leukemias with large spleens. J Clin Pathol 1987;40:642–51.
68. Melo J.V., Robinson D.S.F., Gregory C. et al. Splenic lymphoma with «villous» lymphocytes in the peripheral blood: a disorder distinct from hairy cell leukemia. Leukemia 1987;1:294–9.
69. Montalban C., Castrillo J.M., Abraira V. et al. Gastric B-cell mucosa-associated lymphoid tissue (MALT) lymphoma: clinicopathological study and evaluation of the prognostic factors in 143 patients. Ann Oncol 1995;6:355–62.
70. Zinzani P.L., Magagnoli M., Galieni P. et al. Nongastrointestinal low-grade mucosa-associated lymphoid tissue lymphoma: analysis of 75 patients. J Clin Oncol 1999;17:1254–8.
71. Sheibani K., Burke J.S., Swartz W.G. et al. Monocytoid B-cell lymphoma: clinicopathologic study of 21 cases of a unique type of low-grade lymphoma. Cancer 1988;62:1531–8.
72. Traweek S.T., Sheibani K. Monocytoid B-cell lymphoma: the biological and clinical implication of peripheral blood involvement. Am J Clin Pathol 1992;97:591–8.
73. Isaacson P.G., Dogan A., Price S.K., Spencer J. Immunoproliferative small-intestinal disease. An immunohistochemical study. Am J Surg Pathol 1989;13:1023–33.
74. Isaacson P.G., Matutes E., Burke M. The histopathology of splenic lymphoma with villous lymphocytes. Blood 1994;84:3828–34.
75. Duong Van Huyen J.P., Molina T., Delmer A. et al. Splenic marginal zone lymphoma with or without plasmacytic differentiation. Am J Surg Pathol 2000;24:1581–92.
76. Thieblemont C., Berger F., Dumontet C. et al. Mucosa- associated lymphoid tissue lymphoma is a disseminated disease in one third of 158 patients analyzed. Blood 2000;95:802–6.
77. Thieblemont C., Felman P., Gallet-Bouchu E. et al. Splenic marginal zone lymphoma: a distinct clinical and pathological entity. Lancet Oncol 2003;4:95–103.
78. Mollejo M., Menarguez J., Floret E. et al. Splenic marginal zone lymphoma: a distinctive type of low grade B-cell lymphoma. A clinicopathological study of 13 cases. Am J Surg Pathol 1995;19:1146–57.
79. Labouyrie E., Chartois-Leaute A.G., Dubus P. et al. Splenic lymphoma with villous lymphocytes: morphologic, immunologic and molecular study. Report of three cases. Ann Pathol 1996;16(4):285–91.
80. Henrique R., Achten R., Maes B. et al. Guidline for subtyping small B-cell lymphomas in bone marrow biopsies. Virchows Arch 1999;435:549–58.
81. Meuge-Moraw C., Delacretaz F., Baur A.S. Follicular dendritic cells in bone marrow lymphoproliferative diseases: an immunohistochemical study including a new paraffin-resistant monoclonal antibody, DR53. Histopathology 1996;28(4):341–7.
82. Malek S.N., Hatfield A.J., Flinn I.W. Malt Lymphomas. Curr Treat Option Oncol 2003;4(4):269–79.
83. Чигринова Е.В. Поражение костного мозга при периферических В-клеточных неходжкинских лимфомах. Автореф. дис. … канд. мед. наук. М., 2006.
84. Османов Д.Ш. Поражение костного мозга при неходжкинских лимфомах. Автореф. дис. … докт. мед. наук. М., 2004.
85. Chen P.M., Fan S., Lin S.H. et al. Study of bone marrow cells in non-Hodgkin's lymphoma by DNA analysis. Leuk Res 1991;15(12):1097–106.
86. Gong J.Z., Zheng S., Chiarle R. et al. Detection of immunoglobulin kappa light chain rearrangements by polymerase chain reaction: an improved method for detecting clonal B-cell lymphoproliferative disorders. Am J Pathol 1999;155:355–63.
87. Dunphy C.H. Applications of flow cytometry and immunohistochemistry to diagnostic hematopathology. Arch Pathol Lab Med 2004;128(9):1004–22.
88. Dunphy C.H. Combining morfology and flow cytometric immunophenotyping to evaluate bone marrow specimens for B-cell malignant neoplasms. Am J Clin Pathol 1998;109(5):625–30.
89. Mazur G., Halon A., Wrobel T. et al. Contribution of flow cytometric immunophenotyping and bone marrow trephine biopsy in the detection of lymphoid bone marrow infiltration in non-Hodgkin's lymphomas. Neoplasma 2004;51(3):159–63.
90. Perea G., Altes A., Bellido M. et al. Clinical utility of bone marrow flow cytometry in B-cell non-Hodgkin lymphomas (B-NHL). Histopathology 2004;45(3):268–74.
91. Тупицын Н.Н., Кадагидзе З.Г. Иммунодиагностика гемобластозов человека. Пособие для врачей М., Издательская группа ГУ РОНЦ им. Н.Н. Блохина РАМН; 2003. с. 11–24.
92. Conlan M.G., Bast M., Armitage J.O., Weisenburger D.D. Bone marrow involvement by non-Hodgkin's lymphoma: the clinical significance of morphologic discordance between the lymph node and bone marrow. Nebraska Lymphoma Study Group. J Clin Oncol 1990;8(7):1163–72.
93. Costes V., Duchayne E., Taib J. et al. Intrasdinusiodal bone marrow infiltration: a common growth pattern for different lymphoma subtypes. Br J Haematol 2002;119:916–22.
94. Dierlamm J., Wlodarska I., Michaux L. et al. Genetic abnormalities in marginal zone b-cell lymphomas. Hematol Oncol 2000;18:1–13.
95. Dong H.Y., Gorczyca W., Liu Z. et al. B-cell lymphomas with coexpression of CD5 and CD10. Am J Clin Pathol 2003;119(2):218–30.
96. Farhi D.C., Chai C.C. Pathology of bone marrow and blood cells. Lippincott, Williams and Williams, 2004. p. 117–28.
97. Frich B., Lewis S.M. et al. Biopsy pathology of bone and bone marrow. NY Raven Press; 1985.
98. Isaacson P.G. Mucosa-associated lymphoid tissue lymphoma. Semin Hematol 1999;36:139–47.
99. Jaffe E.S., Harris N.L., Stein H., Vardiman J.W. (eds.) World Health Organisation classification of tumours pathology and genetics of tumours of hematopoetic and lymphoid tissues. Lyon, IARC Press; 2001.
100. Kremer M., Spitzer M., Mandl-Weber S. et al. Discordant bone marrow involvement in diffuse large B-cell lymphoma: comparative molecular analysis reveals a heterogeneous group of disorders. Lab Invest 2003;83(1):107–14.
101. Macavei I., Galatar N. Bone marrow biopsy (BMB). I. Generalities, material and method, normal structure of bone marrow, pathological conditions. Morphol Embryol (Bucur) 1989;35(1):33–40.
102. Mateo M., Mollejo M., Villuendas R. et al. 7q31-32 allelic loss is a frequent finding in a splenic marginal zone lymphoma. Am J Pathol 1999;154:1583–9.
103. Navone R., Valpreda M., Pich A. Lymphoid nodules and nodular lymphoid hyperplasia in bone marrow biopsies. Acta Haemathol 1985;74(1):19–22.
104. Picker L.J., Medeiros L.J., Weiss L.M. et al. Expression of lymphocyte homing receptor antigen in non-Hodgkin's lymphoma. Am J Pathol 1988;130:496–504.
105. Rywlin A.M., Ortega R.S., Dominguer C.J. Lymphoid nodules of bone marrow, normal and abnormal. Blood 1974;43(3):389–400.



