Рак пищевода является высоко агрессивной злокачественной опухолью, имеющей крайне неблагоприятный прогноз. По данным Koshy M. и соавторов, в 2001 году соотношение числа больных умерших от рака пищевода к числу больных с впервые установленным диагнозом составило 0,95. К примеру, этот же показатель при раке прямой кишки составляет 0,23, при раке молочной железы – 0,21, при раке предстательной железы – 0,16. И только при раке легкого, соотношение числа умерших пациентов, к числу впервые выявленных случаев заболевания составляет 0,93, что не намного ниже этого показателя при раке пищевода.
На наш взгляд, этот показатель отражает не только недостатки в диагностике рака пищевода, но и эффективность применяющихся на сегодняшний день методов лечения. Так, исходя из приведенных цифр, можно сделать вывод о том, что лечение оказывается успешным менее чем в 10% случаев. В свете вышесказанного, неудивительно, что по данным литературы общая 5-летняя выживаемость по всем стадиям рака пищевода колеблется от 2 до 8%.
Низкую выживаемость больных можно объяснить запущенностью опухолевого процесса к моменту их обращения за медицинской помощью; у большинства пациентов (60-80%) возможно лишь симптоматическое улучшение при проведении паллиативного лечения.
Преобладающим гистологическим типом является плоскоклеточный рак пищевода. В то же время следует отметить повышающуюся, особенно в течение последних двух десятилетий, частоту аденокарциномы пищевода, особенно в США и западноевропейских странах. Основными причинами этого многие авторы считают ожирение и гастроэзофагеальный рефлюкс с формированием пищевода Барретта. Одновременно, такая же тенденция отмечается в отношении аденокарциномы кардии желудка, что, собственно, и привело к формированию термина аденокарцинома кардиоэзофагеального перехода. По данным Kaklamanos I.G. и соавторов, в западных странах на долю аденокарцином приходится около 50% всех случаев рака пищевода.
Исторически, основными методами лечения рака пищевода на более ранних стадиях являются хирургическое или лучевое лечение; при этом 5-летняя выживаемость у этой группы больных составляет лишь 10-20%. При ранних формах рака пищевода хирургическое лечение с выполнением расширенной лимфодиссекции остается основным методом лечения рака пищевода. В течение последних десятилетий эффективность хирургического лечения возросла, увеличились показатели резектабельности опухоли. Благодаря активной предоперационной подготовке с коррекцией сопутствующей патологии, грамотному послеоперационному ведению больных, показатели смертности после оперативного вмешательства снизились до 5%; удалось добиться значительного снижения частоты послеоперационных осложнений.Радикальное хирургическое лечение с расширенной лимфодиссекцией у пациентов с инвазией слизистой и подслизистой оболочки повышает 5-летнюю выживаемость до 40%.С течением времени, при отсутствии лечения увеличиваются размеры опухоли, глубина инвазии и распространенность опухолевого процесса. Онкологам чаще всего приходится иметь дело с опухолью, распространившейся за пределы стенки пищевода, с обширным вовлечением регионарных лимфоколлекторов и с наличием отдаленных метастазов. Более того, частота выявления регионарных метастазов даже при ранних формах рака достигает 25 % (см рис 1):
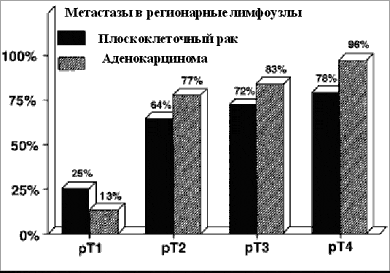
Рисунок 1. Распределение метастазов в регионарные лимфатические узлы при раке пищевода в зависимости от стадии Т и гистологического типа опухоли
Для более поздних стадий заболевания, пятилетняя выживаемость пациентов после хирургического лечения остается низкой, и составляет: от 15 до 30% – для IIA стадии, от 5 до 15% – IIB стадии заболевания.
В настоящее время только лучевое лечение при раке пищевода применяется в тех случаях, когда имеются противопоказания к проведению химиотерапии. Это связано с тем, что в ряде рандомизированных клинических испытаний чётко доказано преимущество химиолучевого лечения над чисто лучевым лечением. При использовании лучевого лечения медиана жизни больных колеблется в пределах 6 – 12 месяцев, , 5-летняя выживаемость меньше 10%, частота локорегионарных рецидивов достигает 84%.Sykes AJ и соавторы привели результаты исследования, включавшего наблюдения 101 больного плоскоклеточным раком пищевода и линейной протяженностью поражения менее 5 см. Суммарная очаговая доза лучевой терапии составила 45 – 52 Гр, 5-летняя выживаемость составила 20%.
Wan J и соавторы провели мета-анализ рандомизированных клинических испытаний и не обнаружили улучшения показателей выживаемости после лучевой терапии. Таким образом, по мнению Koshy M и соавторов, роль лучевой терапии в радикальном лечении рака пищевода должна быть лимитирована, радиотерапию следует рассматривать как метод паллиативного лечения. Как метод радикального лечения рака пищевода при наличии противопоказаний к оперативному вмешательству, химиолучевое лечение получило признание, после того как в нескольких нерандомизированных клинических испытаниях были получены лучшие результаты, чем при чисто лучевом лечении.
В одном из таких нерандомизированных исследований, выполненных в Госпитале Принцессы Маргариты (Торонто, Канада), 35 больным плоскоклеточным раком пищевода провели химиотерапию препаратами 5-фторурацил и Цисплатин и дистанционную лучевую терапию в суммарной очаговой дозе 40-50 Гр [Keane TJ et al, 1985]. При сравнении исследуемой группы с историческим контролем оказалось, что в группе с химиолучевым лечением двухлетняя выживаемость составила 28%, в историческом контроле – 15% (р=0,004). С 1980 по 1989 год, Coia LR и соавторы провели проспективное исследование с включением 90 наблюдений больных плоскоклеточным раком и аденокарциномой пищевода I и II стадий. Для ранних стадий рака пищевода, 5-летняя выживаемость составила 18%, частота локорегионарных рецидивов составила 25%. Из 29 пациентов с прогрессированием заболевания, у 72% генерализация носила системный характер, у 48% - развились местные рецидивы. Как отмечено выше, частота локорегионарных рецидивов в исторической контрольной группе пациентов, получавших лучевое лечение, достигала 84%. Уменьшение частоты местных рецидивов иллюстрирует роль химиотерапии в достижении этого эффекта.
Одно из самых крупных рандомизированных испытаний выполнено Roussel А и соавторами. В исследование включены наблюдения 221 больного с плоскоклеточным раком пищевода, которые были рандомизированы для получения химиолучевого или чисто лучевого лечения. В группе с комбинированным лечением медиана выживаемости для ранних стадий рака пищевода (I и II стадия) составила 47 месяцев, в группе с чисто лучевым лечением – 31 месяц, 2-летняя выживаемость 20% и 16%, соответственно. Частота местных рецидивов составила 59% для группы с химиолучевым лечением и 66% для группы с чисто лучевым лечением.
В ряде других рандомизированных исследований были получены схожие результаты. Частота опасных для жизни осложнений при проведении химиолучевого лечения колеблется от 20 до 44%, примерно 16% пациентов умерли во время такого лечения. Симптоматическое улучшение достигается только у половины пациентов, у 40% не наблюдается уменьшение выраженности дисфагии.
Таким образом, результаты химиолучевого лечения на ранних стадиях рака пищевода хуже результатов хирургического лечения, особенно по показателю частоты развития локорегионарных рецидивов. Поэтому на современном этапе развития онкологии, химиорадиотерапия как метод радикального лечения ранних форм рака пищевода должна рассматриваться только при наличии противопоказаний к хирургическому вмешательству.
Для улучшения в целом неблагоприятных результатов хирургического, лучевого или химиолучевого лечения в последнее время были предложены адъювантные и неоадъювантные комбинированные методы лечения рака пищевода .Использование лучевой терапии в послеоперационном периоде исторически было обусловлено высокой частотой местных рецидивов после хирургического лечения. На сегодняшний день известны результаты пяти рандомизированных исследований с использованием в послеоперационном периоде лучевого лечения в СОД 43 – 56 Гр. Ни в одном из этих исследований не выявлено улучшения показателей выживаемости.
Xiao ZF и соавторы опубликовали результаты рандомизированного клинического испытания, завершенного в 1997 году. Методом конвертирования, наблюдения 495 пациентов, оперированных по поводу резектабельного рака пищевода, разделены на контрольную группу и группу, в которой пациенты после операции получали лучевое лечение в СОД 50 – 60 Гр. Пятилетняя выживаемость в основной группе составила 41,3%, в контрольной – 31,7%, однако различия не достигли статистической достоверности. Вместе с тем, уменьшение частоты развития внутригрудных рецидивов при применение лучевого лечения в послеоперационном периоде в сравнении с хирургическим лечением оказалось статистически достоверным: 25% – в группе с чисто хирургическим лечением против 16,2% – в группе с комбинированным лечением (р=0,0015). Tenierie P и соавторы опубликовали результаты рандомизированного клинического испытания, в котором наблюдения 221 пациента с плоскоклеточным раком пищевода были разделены на две группы: в основной группе больные получали чисто хирургическое лечение; в контрольной больным в послеоперационном периоде выполняли дистанционную лучевую терапию в суммарной очаговой дозе 45-55 Гр и с разовой очаговой дозой 1,8 Гр. Общая выживаемость в исследуемых группах не отличалась, однако локорегионарные рецидивы встречались достоверно ниже в основной группе: 35% vs 10%.
Японская группа по изучению рака пищевода и Pouliquen X. и соавторы, независимо друг от друга провели рандомизированные клинические испытания, в которых после хирургического вмешательства больным проводили системную химиотерапию препаратами Цисплатин + 5-фторурацил (или виндезин). Улучшение показателей выживаемости не выявлено ни в одном из этих исследований. Вместе с тем, полученные на сегодняшний день обнадеживающие результаты неоадъювантной предоперационной терапии у больных аденокарциномой или плоскоклеточным раком пищевода, не позволяют сделать окончательных выводов.
Неоадъювантное лечение приводит к уменьшению основной массы опухоли у большинства больных, приводит к повышению резектабельности, уменьшает риск интраоперационного обсеменения раны опухолевыми клетками. Кроме того, гистологическое исследование удаленного препарата даёт возможность объективно оценить эффект проведенного до операции лечения. Существуют несколько теоретических и экспериментальных обоснований применения химиотерапии и/или лучевой терапии именно на предоперационном этапе лечения больных раком пищевода. Экспериментальные исследования показывают, что оперативное вмешательство стимулирует рост клеток опухоли, остающихся в организме пациента после операции. Об этом свидетельствуют повышение индекса пролиферации, значительное уменьшение времени репликации клетки и быстрое увеличение количества и размеров отдаленных метастатических очагов после оперативного вмешательства. Повышение индекса пролиферации может сопровождаться мутациями, приводящими к формированию клонов клеток резистентных к химиотерапии.
Дополнительным аргументом в пользу применения неоадъювантного лечения (химиотерапии) на предоперационном этапе является лучшая доставка химиотерапевтических агентов в опухолевую ткань в условиях нескомпрометированного хирургическим вмешательством кровотока в ложе опухоли. У больных с местно-распространенным поражением пищевода применение методов неоадъювантного лечения приводит к уменьшению местной распространенности процесса. Учитывая особенности анатомии средостения (наличие жизненноважных анатомических структур, прилежащих к пищеводу), предоперационное лечение, таким образом, увеличивает шансы на полное удаление опухоли. Важным вопросом предоперационного лечения, ограничивающим его широкое применение, является повышение частоты послеоперационных осложнений и летальности, а также иммуносупрессивное действие радио и химиотерапии.
Автор: к.м.н. Э.А.Сулейманов /материал взят из диссертации "Непосредственные результаты предоперационной химиотерапии по схеме FLEP и хирургического лечения у больных раком грудного отдела пищевода" автор Э.А.Сулейманов.



