 Доклад (Заседание Московского Онкологического Общества № 529; тема Интраоперационная химиотерапия: оценка эффективности воздействия на интраперитонеальные местастазы)
Доклад (Заседание Московского Онкологического Общества № 529; тема Интраоперационная химиотерапия: оценка эффективности воздействия на интраперитонеальные местастазы)
Авторы: Неред С.Н., Клименков А.А., Стилиди И.С., Перевощиков А.Г., Губина Г.И., (РОНЦ им. Н.Н.Блохина)
Улучшение результатов хирургии рака желудка связывается с поиском возможностей предупреждения имплантационного метастазирования, когда диссеминация по брюшине происходит в результате распространения опухолевых клеток через свободную брюшную полость, минуя лимфатический барьер.
Поскольку канцероматоз брюшины является основной причиной летальных исходов больных раком желудка, определение групп больных раком желудка с высоким риском имплантационного метастазирования, изучение результатов применения методов профилактики и лечения при канцероматозе брюшины являются актуальной проблемой.
Изучено прогрессирование рака желудка после 303 считавшихся радикальными операций и характер (проявления) прогрессирования после 205 паллиативных гастрэктомий и резекций желудка. Установлена вероятность развития имплантационных метастазов не только от глубины и площади поражения желудочной стенки, но и макро- и микроскопического строения опухоли.
a)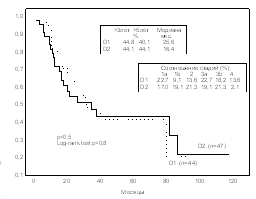
b)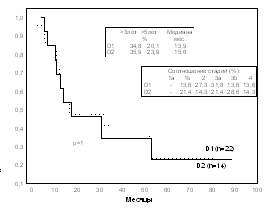
c)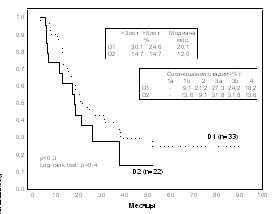
d)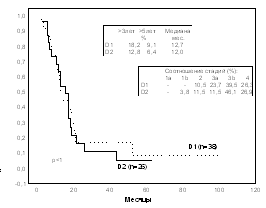
Рис. 1 Продолжительность жизни больных раком желудка в группах высокого риска имплантационного метастазирования после операций с D1 и D2-лимфодиссекцией: при перстневидноклеточном (а), недифференцированном раке (b), диффузно-инфильтративной форме роста (с), тотальном поражении желудка (d).
Наиболее часто имплантационные метастазы обнаружены при перстневидноклеточном (65,0%) и недифференцированном (60,3%) раке, при диффузно-инфильтративной форме роста опухоли (61,0%), при тотальном поражении желудка (59,0%). Причем, если перстневидноклеточный и недифференцированный рак досто-верно чаще метастазировали по брюшине, то аденокарцинома, особенно высоко- и умереннодифференцированная, чаще (р<0,001) метастазировала в печень. Таким образом, выявлена важная особенность отдаленного метастазирования рака желудка – способность его различных морфологических форм по-разному метастазировать в отдаленные органы и ткани.
Эффект от лимфодиссекции в группах высокого риска имплантационного метастазирования может не проявиться из-за быстрого развития канцероматоза брюшины. Анализ отдаленных результатов после операций с D1 и D2 лимфодиссекцией (у 319 и 242 больных соответственно) показал, что при раке желудка в группах высокого риска имплантационного метастазирования (при перстневидноклеточном и недифференцированном раке; диффузно-инфильтративной форме роста, при тотальном поражении желудка) D2-лимфодиссекция не приводит к улучшению выживаемости (рис.1).
Напротив, в группах больных с относительно низкой частотой метастатического поражения брюшины отмечена высокая эффективность расширенных лимфодиссекций. Так, при аденокарциноме, составляющей большинство опухолей желудка, D2-лимфодиссекция приводит к статистически достоверному улучшению отдаленных результатов (рис. 2 a), причем улучшение результатов прослеживается при различной степени дифференцировки аденокарциномы; важно отметить, что улучшение выживаемости наблюдается даже в случаях поражения опухолью серозной оболочки (рис. 2 b).
a)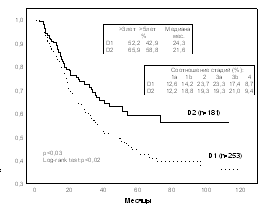
b)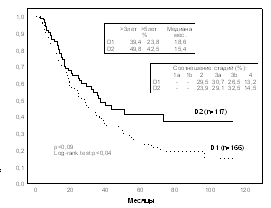
Рис. 2 Продолжительность жизни больных раком желудка после операций с D1 и D2 лимфодиссекцией при аденокарциноме ( a – все больные, b – больные с опухолями Т3-Т4)
Таким образом, выявленные особенности отдаленного метастазирования рака желудка являются основа-нием для дифференцированного подхода к обследованию и лечению. Отсутствие эффекта от применения D2 лимфодиссекции в группах высокого риска имплантационного метастазирования указывает на необходимость разработки дополнительных методов лечения этой категории больных.
В 1990–2000-х гг. основные надежды в отношении профилактики и лечения канцероматоза брюшины возлагались на внутрибрюшинную химиотерапию. Теоретическим обоснованием внутрибрюшинного проведения химиотерапии является возможность создания значительной концентрации противоопухолевых препаратов в перитонеальной жидкости в 1,5-3,6 раза превышающей их концентрацию в плазме крови при внутривенном введении. Это позволяет рассчитывать на преодоление лекарственной устойчивости опухолевых кле-ток и менее выраженные побочные системные эффекты химиотерапии.
В РОНЦ проведена интраперитонеальная полихимиотерапия 74 больным раком желудка (35 – после радикальных и 39 – после паллиативных операций). Интраперитонеально вводился 5-фторурацил (по 600мг/м2 в 1-4-й дни) и цисплатин (100мг/ м2 в 5-й день). Химиотерапия проведена 32 больным до и после операции, 21 – до операции, 21 – после операции. Метод характеризовался умеренной токсичностью, не сопровождался увеличением частоты послеоперационных осложнений. Объективный эффект, в том числе при канцероматозе брюшины, проявлялся исчезновением асцита, уменьшением количества и размеров перитонеальных метастазов.
Это позволяет считать методом выбора включение внутрибрюшинных курсов химиотерапии в общую схему противоопухолевого лечения больных неоперабельным раком желудка с канцероматозом брюшины. Вместе с тем, интраперитонеальная полихимиотерапия с использованием 5-фторурацила и цисплатина в указанном режиме, не привела к достоверному улучшению отдаленных результатов после радикальных и паллиативных гастрэктомий и резекций желудка. В группе больных, получивших профилактическую полихимиотерапию, медиана выживаемости составила 23,4 мес, 3- и 5-летняя выживаемость 44,0% (сравнительно с показателями 18,7 мес, 56,7 и 43,5% в контрольной группе). После паллиативных вмешательств с интраперитонеальной полихимиотерапией медиана выживаемости составила 8 мес, 1-2-летняя выживаемость 15,3 и 7,6%, сравнительно с показателями 5,8 мес, 25,1 и 3,8% в контрольной группе. Следует отметить, что среди больных, у которых операция выполнена на фоне имевшихся имплантационных метастазов, анализируемые показатели выживаемости после интраперитонеальной полихимиотерапии составили 8,3 мес, 49,8 и 9,6%, без нее – 6,8 мес, 38,3 и 0% (p>0,05).
Появление новых химиопрепаратов, в частности таксанов, а также разработка методики интраоперационной гипертермической перфузии, дают возможность дальнейшего улучшения результатов лечения.
По материалам Вестника Московского Онкологического Общества, № 6-8, июнь-август 2006г.



