К.В. Максимов, И.В. Высоцкая, В.Д. Ермилова, В.П. Летягин,
Е.М. Погодина, Г.Ю. Чемерис, А.Д. Зикиряходжаев, Е.А. Ким,
Г.В. Мартынова
ГУ РОНЦ им. Н.Н. Блохина РАМН, Москва
Целью исследования явилось определение наиболее эффективных схем нео- и адъювантной терапии первичного рака молочной железы Т
Рак молочной железы (РМЖ) прочно удерживает первое место в структуре онкологической заболеваемости. Статистические данные последнего десятилетия свидетельствуют о неуклонном росте показателей заболеваемости и смертности, как во всем мире, так и в России. С 1993 по 2003гг. стандартизированные показатели заболеваемости РМЖ в России увеличились на 19%, смертности на 12%. Ежегодный прирост заболеваемости составляет около 5,8% [2]. Немаловажную роль в исходе заболевания играет состояние овариально-менструальной функции женщины, ее возраст, состояние репродуктивной системы, генетические факторы, особенности характера питания, наличие дисгормональных заболеваний молочных желез [3, 4, 5, 6]. Спорным до настоящего времени остается вопрос о выборе тактики лечения РМЖ при разных стадиях злокачественного процесса. В особенности интерес представляет группа больных, у которых выраженный неопластический процесс, поражает большой объем ткани железы и в то же время не метастазирует в регионарные лимфатические узлы (Т
По определению, операбельность при РМЖ подразумевает не просто техническую возможность полного удаления опухоли, но и возможность достижения стойкого местно-регионарного контроля болезни. Случаи местно-распространенного РМЖ, относящиеся к IIIа стадии, формально являются первично операбельными, хотя по своим биологическим характеристикам их операбельность условна. Для этой категории предпочтительной считается тактика начала лечения с использованием предоперационной терапии [1, 14, 17]. Индукционная терапия, особенно в группе больных с первично неоперабельными опухолями, дает возможность выполнить адекватное хирургическое вмешательство, и, кроме того, увеличить показатели общей и безрецидивной выживаемости.
Проблема оценки операбельности местнораспространенного (или первично неоперабельного) РМЖ существует только в отношении больных, у которых в результате предоперационного лечения наступает частичный эффект или стабилизация болезни. Больные с прогрессированием процесса остаются иноперабельными, операция возможна только с паллиативной целью (распад опухоли) но не сцелью достижения ремиссии. Больные, леченные с полным эффектом, безусловно, операбельны. Решение о целесообразности операции у них основано на сомнении в точности оценки полноты эффекта. Правильное определение операбельности позволяет оптимизировать лечение за счет отказа от операций, сопровождающихся быстрым местнорегионарным рецидивом болезни, в пользу модификации и интенсификации консервативного лечения [4, 6].
В настоящее время нет четких данных об этапности, продолжительности и преимуществе различных методов лечения у данной категории больных. При сравнении различных схем комплексного лечения, особенно при IIIб стадии, некоторые авторы [8, 9, 11, 15] приходят к мнению, что отдаленные результаты статистически не отличаются и в большей степени зависят от распространенности процесса, чем от лечебной тактики.
Необходимость проведения предоперационного лечения при местнораспространенном РМЖ с ХТ продемонстрировал A.Fourquet et. al. (1993). Они сравнили эффективность последовательности проведения лекарственного и лучевого лечения у 390 больных РМЖ T
U. Cuskun et. al. (2003г) описывают свой опыт проведения предоперационной ХТ у 91 больной местнораспространенным РМЖ при llla (n=30) и lllб (n=61) стадиях. Лекарственное лечение с применением антрациклинов (FAC или AC, FEC или EC), а также CMF была эффективна в 91, 82 и 60% случаев, соответственно (p=0.05). M. Machiavelli et. al. (1996) проводили комбинированное лечение 140 больных РМЖ IIIa и IIIб стадий по схеме: 3 курса ХТ по схеме FAC + модифицированная РМЭ. Клинический эффект отмечен у 71%, стабилизация у 26%, прогрессирование у 3% больных. Автор отмечает некоторое несовпадение клинического и морфологического эффектов. При полном эффекте, определяемом морфологически, безрецидивная и общая заболеваемость у пациенток были лучше, чем при частичном эффекте или стабилизации. Данные крупных исследований ll и lll фазы применения химиотерапии продемонстрировали, что дооперационное лечение в течение 3-4 месяцев может быть назначено без риска снижения эффективности местно-регионарного контроля и долгосрочной выживаемости [3].
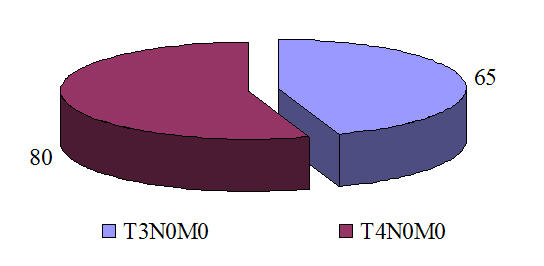
В нашем исследовании распределение больных по стадиям было следующим (рис. 1): T
Рис. 1. Распределение больных местнораспространенным РМЖ в зависимости от стадии
В зависимости от овариально-менструального статуса больные распределены следующим образом: наибольшее количество пациенток (105 (72,4%) относилось к периоду менопаузы, у 40 (27,6%) больных менструальная функция была сохранена. Менопауза менее 5 лет отмечена у 34 (23,4%) больных (по 17 пациенток в каждой группе), в менопаузе более 5 лет находилась 71 (48,9%) пациентка, причем большая часть которых (52 человека) относилась к группе с lllб стадией заболевания.
Всем больным в нашем исследовании было выполнено хирургическое вмешательство различного объема. Так, радикальная мастэктомия с сохранением обеих грудных мышц выполнена 123 (85%) пациенткам, органосохранная операция в объеме радикальной резекции 22 (15%) больным.
В зависимости от проводимого лечения пациентки изучаемой группы распределились следующим образом (рисунок 2).
Рис. 2. Распределение больных местнораспространенным РМЖ в зависимости от видов лечения
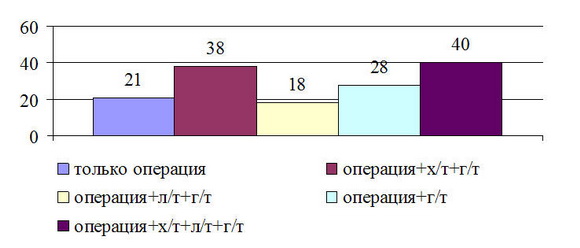
Как видно из данных рисунка наибольшее количество больных получило комбинированное, либо комплексное лечение. Чисто хирургически лечена всего 21(14,5%) больная.
Неоадьювантное лечение получили 5 (3,5%) пациенток с T
Отмечено, что 21 (46,7%) больная до операции получила различную химиотерапию. Только лучевая терапия применена в 11 (24,4%) клинических случаях, относящихся к T
Наиболее часто – у 23 (71,9%) пациенток, в качестве предоперационной химиотерапии использовались атрациклинсодержащие комбинации (CAF; AC; AT), гораздо реже применялись другие режимы лечения (CMF, CMFVP) - 9 (28,2%) больных и в группе больных с T
У большинства (62%) больных стадии T3N0M0, в неоадьювантном режиме, проводилась лучевая терапия в режиме укрупненного фракционирования дозы РОД-5Гр. до СОД-20Гр. на молочную железу и подмышечную область. При более распространенном процессе (lllб стадия), предоперационная лучевая терапия проводилась мелкими фракциями РОД-2Гр. до СОД-40-44Гр. на молочную железу и зоны регионарного лимфооттока. Аналогичную лучевую терапию получили 13% больных с llб стадией, с той лишь разницей, что суммарная доза облучения составляла 36Гр.
Оценка эффективности проводимого лечения базировалось на клинической динамике (клинико-рентгенологических данных) и степени лечебного патоморфоза. Так, уменьшение размеров опухолевого узла, отека и гиперемии кожи молочной железы наблюдалось у большинства больных – 24 (54,2%). Клинический эффект от проведенного неоадъювантного лечения был отмечен у 6 (37,5%) больных в группе IIб стадии и у 18 (62,1%) пациенток при IIIб стадии опухолевого процесса. Морфологически наблюдаемый лечебный патоморфоз различной степени выраженности отмечается практически у половины больных – 24 (53%).
Так, лечебный патоморфоз по гистологическим данным чаще отмечался у пациенток с IIIб стадией опухолевого процесса по сравнению с менее распространенными больными. Лечебный патоморфоз l-ll степени отмечен в 34 (77%) клинических случаях, патоморфоз lll степени установлен у 7 (16,1%) пациенток и полный (IV степень) у 3 (6,7%) больных. Причем наличие абсолютного лечебного патоморфоза было характерно для группы больных с T
Рассматривая степень лечебного патоморфоза, в зависимости от схемы проведенного лечения следует отметить, что в группе больных с T
Любопытны результаты, получены при изучении группы больных, у которых помимо хирургического лечения проводилась химио-лучевая ± гормонотерапия. В большинстве случаев (59% в стадии llб и 74% в стадии lllб) лечение было начато с неоадъювантного этапа. У всех больных был достигнут лечебный патоморфоз той или иной степени выраженности. У абсолютного большинства больных установлен лечебный патоморфоз l и ll степени (90% - в группе T
Таким образом, следует отметить, что наиболее эффективными схемами лечения данных групп больных были сочетания методов, где в неоадъювантном режиме использовалась только химиотерапия (28,9%), либо химио-лучевая ± гормонотерапией (60,3%). Причем у 38% пациенток из первой группы и у 58% из второй был отмечен выраженный лечебный патоморфоз. При неоадъювантном применении только лучевой терапии максимальная выраженность дегенеративных изменений опухолевой ткани соответствовала l-ll степени патоморфоза.
Анализ результативности различных вариантов лечения в зависимости от продолжительности жизни леченных больных в T
Рис. 3. Общая выживаемость больных РМЖ T3N0M0 стадией в зависимости от различного лечения
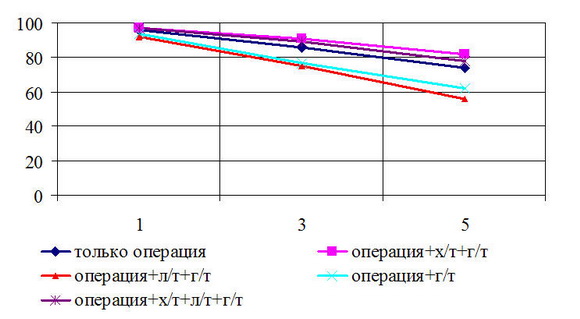
Общая 5-летняя выживаемость у больных с T3N0M0 стадией в зависимости от вида лечения составила: только операция – 74%; операция + химио ± гормонотерапия – 82%; операция + лучевая ± гормонотерапия – 56%; операция + гормонотерапия – 62%; операция + химио-лучевая ± гормонотерапия – 78%, соответственно.
Рис. 4. Безрецидивная выживаемость больных РМЖ T3N0M0 стадией в зависимости от вида лечения
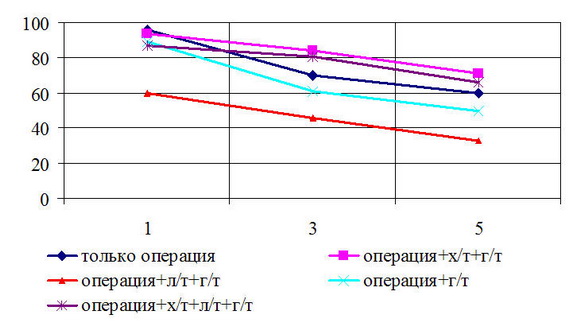
Безрецидивная 5-летняя выживаемость у больных с T
Общая 5-летняя выживаемость у больных с T
Рис. 5. Общая выживаемость больных РМЖ T4N0M0 стадией в зависимости от вида лечения
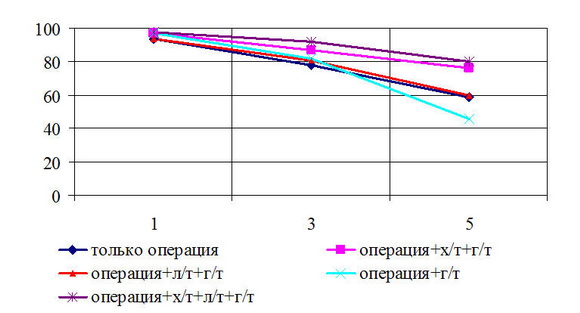
Безрецидивная 5-летняя выживаемость у больных с T
Рис. 6. Безрецидивная выживаемость больных РМЖ T4N0M0 стадией в зависимости от вида лечения
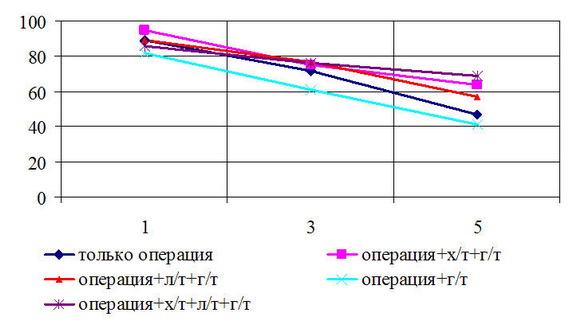
Показатели 5-летней выживаемости у пациенток, которым выполнена радикальная мастэктомия с сохранением грудных мышц составили: общая – 88%; безрецидивная – 71%. Для пациенток, которым выполнена операция в объеме радикальной резекции показатели выживаемости составили: общая – 77%; безрецидивная – 64%.
Стабилизация процесса отмечена у 106 (73,1%) больных: 49 (75,3%) пациенток в группе с llб и 57 (71,3%) - в группе с lllб стадией, соответственно. Прогрессирование заболевания отмечено у 39 (26,9%) больных: 16 (24,6%) пациенток в группе с llб и 23 (28,7%) - в группе с lllб стадией. Интервал прогрессирования составил в среднем 19 месяцев (от 0,9 до 89,7 мес.). Причем для группы больных с T
В большинстве (82%) случаев прогрессирование заболевания заключалось в отдаленном метастазировании, у 10% больных отмечен местный рецидив заболевания, у 8% пациенток сочетание местного и отдаленного метастазов. У большинства больных отдаленные метастазы выявлялись в печени (31,4%), легких (25,7%) и костях (17,1%). Наиболее часто (86%) речь шла о метастатическом поражении в пределах одного органа.
Подводя итоги проведенного исследования следует отметить, что после анализа различных подходов к лечению больных раком молочной железы llб и lllб (T
Литература
- Возный Э.К., Добровольская Н.Ю., Гуров С.Н. Некоторые аспекты неоадъювантной терапии местнораспространенного рака молочной железы // Юбилейный сборник «Этюды химиотерапии». – М., 2000.– С. 90-98.
- Давыдов М.И., Аксель Е.М, Статистика злокачественных новообразований в России и странах СНГ.-М., 2005г.- 268с.
- Давыдов М.И., Летягин В.П. Стандарты лечения больных первичным раком молочной железы. – М., 2003. – 148 с.
- Летягин В.П. с соавт. Опухоли молочной железы (клиника, диагностика, лечение, прогноз). – М.: Изд. «ЯРК», 2000. – С. 5-6, 41-44.
- Летягин В.П. Первичные опухоли молочной железы // Практическое руководство по лечению. – М.: Миклош, 2004. – 332 с.
- Летягин В.П., Погодина Е.М., Высоцкая И.В. и др. Лечение больных раком молочной железы стадии T2N1M0 – T3N0M0 // Высокие технологии в онкологии / Материалы V Всероссийского съезда онкологов. – Казань, 2000. – 3. – С.55-56 (б).
- Портной С.М, Лактионов К.П., Барканов А.И. Опыт лечения больных прогностически отягощенным местнораспространенным раком молочной железы // IV Ежегодная российская онкологическая конференция. 21-23 ноября 2000г. Москва. М., 2000. С. 57-59.Семиглазов В.Ф., Семиглазов В.В., Клецель А.Е. Неинвазивные и инвазивные опухоли молочной железы. М., Боргес;2006г.
- Портной С.М, Лактионов К.П., Барканов А.И. Предварительные результаты органосохраняющих операций при раке молочной железы T2-3N0-2M0 после эффективной неоадьювантной терапии // Herald of the International Association of Plastic Surgeon and Oncologists. 2003. N4.P.35.
- Семиглазов В.Ф., Семиглазов В.В., Клецель А.Е. Неинвазивные и инвазивные опухоли молочной железы. – Санкт-Петербург, 2006. – 350 с.
- Coskun U., Gunel N., Onuk E et al. Effect of different neoadjuvant chemotherapy regiments on locally advanced breast cancer // Neoplasma. 2003г. Vol. 50, N 3. P. 210-216.
- Colleoni M, Goldhirsch A. Adjuvant systemic therapies for patients with breast cancer: endocrine responsiveness and effects of chemotherapy.// Curr Probl Cancer. 2003 Jan-Feb;27(1):13-6.
- Colleoni M., Litman H.J., Castiglione-Gertsch M. et al. International Breast Cancer Study Group; German Breast Cancer Study Group // Duration of adjuvant chemotherapy for breast cancer: a joint analysis of two randomised trials investigating three versus six courses of CMF / Br. J. Cancer. – Jun. 2002. – 5. – 86(11). – P. 1705-1714.
- Eltachir A., Heys S.D., Hutcheon A.W. et al. Treatmant of large and locally advanced breast cancer, using neoadjuwant chemotherapy // Am. J. Surg. – 1998. – 172 (2). – P. 127-132.
- Fisher E.R., Wang J., Bryant J. et al. Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18 // Cancer. – 2002. – 95(4). – Р. 681-695.
-
Gajdos C., Tartter P.I., Bleiweiss I.J. et al. Stage 0 to stage III breast cancer in young women // J. Am. Coll. Surg. – May 2000. – 190(5). – P. 523-529. -
Kaufmann M., Hortobagyi G.N., Goldhirsch A. et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: an update. J Clin Oncol 2006; 24:1940-9. -
Kaufmann M., von Minckwitz G., Rody A. Preoperative (neoadjuvant) systemic treatment of breast cancer. Breast 2005;14:576-81. - Mauri D., Pavlidis N., Ioannidis J.P. Neoadjuvant versus adjuvant systemic treatment for breast cancer: a meta- analysis. J Natl Cancer Inst 2005; 97: 188-94.
- Smith I.C., Heys S.D., Hutcheon A.W. et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel. J Clin Oncol 2002; 20: 1456-66.
- Taghian A.G., Jeong J.H., Mamounas E.P. et al. Low locoregional recurrence rate among node-negative breast cancer patients with tumors 5 cm or larger treated by mastectomy, with or without adjuvant systemic therapy and without radiotherapy: results from five national surgical adjuvant breast and bowel project randomized clinical trials // J. Clin. Oncol. – 2006. – 24(24). – 3927-3932.



