У пациентов c диссеминированным раком предстательной железы (РПЖ) эффективна гормональная терапия первой линии, о чем свидетельствует снижение уровня ПСА, регрессия первичной опухоли и метастазов, снижение интенсивности костных болей и улучшение качества жизни. К сожалению, гормональная терапия у этих больных обладает временным эффектом, средняя продолжительность ответа, как правило, не превышает 12- 18 месяцев (Yagoda et al. 1993). Рано или поздно наступает прогрессирование опухолевого процесса. Временный эффект гормональной терапии у больных диссеминированным РПЖ может быть связан с тем, что опухоль представлена тремя популяциями клеток: андрогензависимые клетки – для их развития требуется андрогенная стимуляция; андрогенчувствительные клетки – они не погибают при отсутствии андрогенов, но их рост при этом существенно замедляется; андрогеннезависимые клетки – для их роста не требуются андрогены.
Прогрессирование заболевания на фоне проводимой гормонотерапии связано с ростом клона андрогннезависимых клеток РПЖ (Per-Anders Abrahamson 1999). Кроме того, гормональное лечение РПЖ неэффективно в тех 15-20% случаев, когда опухоль первично резистентна к гормонам.Таким образом, с течением времени РПЖ становится не чувствительным к гормональной терапии и устанавливается диагноз- «гормоно-рефрактерный рак предстательной железы» (ГР-РПЖ). Гормонорезистентность устанавливается при наличии роста уровня ПСА и\или каких-либо других признаков прогрессирования заболевания при адекватной андрогенной блокаде, при условии того, что тестостерон находится на кастрационном уровне (<3 нмоль/л).
Развитие рака – многошаговый процесс, включающий инициацию, пролиферацию, ангиогенез, инвазию и метастазирование, каждый из этих «шагов» представляет собой потенциальную мишень для противораковой терапии (Рис.1).
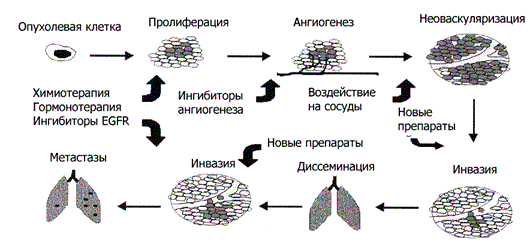
Рисунок1. Стадии канцерогенеза и потенциальные цели противораковой терапии
Некоторые агенты, использующие эти клеточные и молекулярные мишени, в настоящее время проходят испытания в клинических и предклинических исследованиях лечения рака простаты.Современное состояние различных вариантов терапии ГР-РПЖ представлено на рис.2.
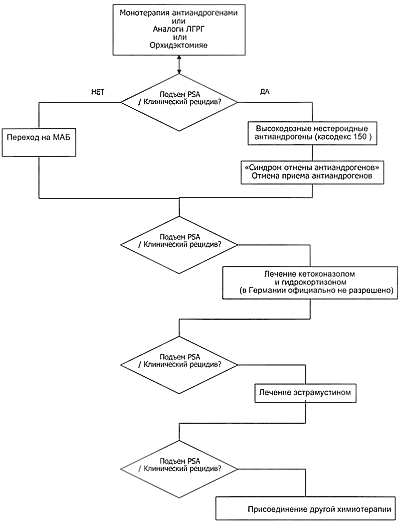
Рисунок2. Схема лечения гормонорефрактерного рака предстательной железы
Гормональная терапия
Применение МАБ в качестве терапии 1-й линии позволяет отсрочить прогрессирование заболевания, снизить клинические проявления, улучшить качество жизни больных РПЖ
Присоединение другой химиотерапии
Scher et al. , Dupont et al. и Small and Srinivas сообщили о формировании т.н. синдрома «отмены» при прекращении гормонотерапии пациентов РПЖ. По данным этих авторов у 14.6% больных отмечалось снижение уровня PSA >=50% после отмены флутамида или бикалютамида. Среднее время ответа составило 3.5 месяца. Fowler et al. сообщили о 54% снижении уровня PSA >= 50% от исходного уровня у больных РПЖ, после отмены флутамида (Crawford et al. 1989; Eisenberger et al. 1997; Fowler et al. 1995).Отмена антиандрогенов в настоящее время является первым стандартным действием при выявлении прогрессирования заболевания у больных РПЖ в США.
Интермитирующая андрогенная блокада
Одним из методов, направленных на предотвращение развития гормональной резистентности РПЖ, является интермитирующая андрогенная блокада (ИАБ). Концепция ИАБ состоит во временной андрогенной блокаде, при которой частично сохраняются стволовые опухолевые клетки. При достижении определенного ответа терапию антиандрогенами прекращают, чтобы дать возможность роста новым клонам андрогенчувствительных клеток РПЖ. Затем терапия возобновляется. Механизм данного метода основан на активности оставшихся стволовых опухолевых клеток, вызывающих рост андрогензависимой колонии, восприимчивой к повторному гормональному лечению (Sciarra et al. 1999).
Данный метод позволяет задержать развитие гормонально-резистентного состояния клеток РПЖ (Goldenberg et al. 1995). При подобной терапии у пациентов РПЖ стадии D2 общая 5-летняя выживаемость составила 52%, причем оценка качества жизни (QOL) продемонстрировала значительное улучшение общего самочувствия, восстановление нормальной половой функции в интервалах между курсами. Интермитирующая гормональная терапия имеет плюсы, связанные с низкой токсичностью и стоимостью лечения.Суммируя опыт наблюдений различных авторов, предполагается, что оптимальными кандидатами для ИАБ являются: больные с местно-распространенным РПЖ без костных метастазов или минимальными метастатическими поражениями (T3-4, N+,M0, или Nx, M+ с костными метастазами ), а также больные с биохимическим рецидивом после лучевой или химиотерапии.
Каждый период лечения ИАБ нужно продолжать в течение времени, за которое регрессия опухоли за счет апоптоза становится максимальной, до появления андрогенрезистентного фенотипа опухоли (Brouchovsky et al. 1990). Разные авторы указывают на оптимальное время цикла 8-9 мес., меньший период времени является недостаточным для достижения стойкого минимума PSA. Остается открытым вопрос о необходимости выполнения дополнительной супрессии в течение 1-3 мес., после достижения минимального уровня PSA.Еще не определен оптимальный интервал времени между циклами андрогенной блокады, но он должен быть адекватным для нормализации тестостероном дифференцировки опухолевых клеток, а также для улучшения качества жизни. Определение времени начала второго цикла решается индивидуально для каждого больного, основываясь на концентрации PSA до лечения и\или динамике PSA, а также на стадии болезни, динамике клинических проявлений, толерантности к андрогенной блокаде. В целом, у пациентов с метастазами и высоким уровнем исходного PSA, лечение снова проводится при повышении уровня PSA до 20 нг/мл. У больных с локализованным раком и умеренно повышенным уровнем PSA до начала лечения, повторная терапия проводится при концентрации PSA 6-15 нг/мл, а у больных с рецидивом после радикальной простатэктомии – при еще меньших концентрациях ПСА (Per-Anders Abrahamson 1999).
Антиандрогенная терапия второй линии
Одним из препаратов, использующихся в качестве гормонотерапии второй линии, является бикалютамид (касодекс). Данный препарат относится к нестероидным, антиандрогенам. Эффективная доза составляет от 50 до 150 мг/сут.В исследовании Joyce et all. (1998), было показано, что применение бикалютамида в дозе 150 мг/сут. являлось эффективным (снижение PSA >= 50%) у 7 из 31 больного ГР-РПЖ. Эффект наблюдался в течение 2-х месяцев, общий ответ составил 22%. Это послужило поводом для поведения подобной работы в России.Учитывая литературные данные о возможности реиндукции ремиссии, т.е. возобновление эффекта у гормонорезистентных больных путем повышения дозы касодекса, в урологическом отделении РОНЦ РАМН изучена группа из 36 больных ГР-РПЖ, которые получали касодекс в дозе 150 мг в сутки внутрь ежедневно.Средний возраст пациентов составил 66 лет (49–82). Всем больным ранее была проведена хирургическая (28) или медикаментозная (8) кастрация. Среднее время до развития гормонорезистентного состояния составило 34 месяца (7 – 104 месяцев). Средний уровень сывороточного ПСА на момент начала лечения составлял 154,3 нг/мл (от 6,2 нг/мл до 618,0 нг/мл). Общее состояние больных, оцененное по шкале ВОЗ, составило: 0 – 18 (50%), 1 – 11 (30,6%), 2 – 3 (8,3%), 3 – 3 (8,3%), 4 – 1 (2,8%).При анализе непосредственных результатов лечения было установлено, что прогрессирование (увеличение уровня ПСА на фоне проводимого лечения в течение 4 недель отмечено у 22 пациентов (61,1%). Ремиссия течение 1 месяца отмечена у 4 пациентов (11,1%), ремиссия в течение 2 месяцев - у 3 (8,3%). Более 4 месяцев нами наблюдалось 7 пациентов (19,5%). Снижение концентрации сывороточного ПСА более чем на 50% отмечено у 6 пациентов (16,7%). Медиана выживаемости составила 11 месяцев.
Существует еще ряд препаратов, которые были апробированы в терапии РПЖ. Кетоконазол - противогрибковый препарат, угнетающий надпочечниковый и тестикулярный синтез андрогенов. Его целесообразно комбинировать с гидрокортизоном во избежание возможной надпочечниковой недостаточности. Указанная комбинация дает снижение PSA в 50% случаев и уменьшение опухоли у 30% больных. Продолжительность ремиссии может достигать 4-х месяцев. При этом следует отметить, что ответ на предлагаемую схему не зависит от предыдущего гормонального лечения, в связи с чем в настоящее время предпринимаются попытки сочетать гормонотерапию с кетоконазолом и стероидами (гидрокортизоном). Стероиды, оказывая воздействие на надпочечники, подавляют выработку андрогенов. Прогестины воздействуют на выработку лютенизирующего гормона, ингибируют 5-альфа редуктазу, что нарушает в свою очередь связь андрогенов с рецепторами. В больших дозах они оказывают цитотоксическое действие. Эффект наблюдался у 15-20% больных. Аминоглютатемид прекращает продукцию андрогенов и эстрогенов. В связи с возможной надпочечниковой недостаточностью его применяют в сочетании с гидрокортизоном. Частота ремиссий при применении этого препарата составляет 32% , а стабилизация процесса - 23% . Отмечен противоопухолевый эффект у антитрипаносомного препарата - Сурамина. В механизме действия Сурамина - связывание рецепторов роста. Однако препарат также может вызывать надпочечниковую недостаточность, поэтому применяется вместе с гидрокортизоном. Было проведено исследование на 458 больных. Одна группа получала Сурамин с гидрокортизоном, а вторая - плацебо с гидрокортизоном. Критериями эффективности лечения были уменьшение болевого синдрома, улучшение качества жизни и показатель ПСА. В группе больных, получавших Сурамин с гидрокортизоном, болевой синдром отсутствовал у 43%, а ПСА снизился более чем на половину у 32% больных (во второй группе - 28% и 16% , соответственно), т.е. результаты в первой группе в 2 раза лучше, чем в группе с плацебо. Сурамин применялся также в комбинации с МАБ, при этом 2-годичная выживаемость больных в стадии D-2 составила 84%.
В последнее время все большее внимание уделяется иммунотерапии. Здесь особый интерес представляет рекомбинантный интерферон альфа, а также его комбинация с ретиноидами. Причем их комбинированное применение оказывается более эффективным, чем использование каждого препарата в отдельности. Уровень ПСА снижается у 40% больных гормоно-резистеным РПЖ. В.Е.Родоман с соавт. (2003) сообщили об эффективности применения биологически активной пищевой добавки «Иммуновит» у больных ГР-РПЖ в сочетании с МАБ. С учетом всех клинических и лабораторных показателей применение иммуновита оценено, как положительное в 57,1% наблюдений. С учетом тяжести изученного контингента больных и неблагоприятного ближайшего прогноза полученные данные авторы расценивают, как обнадеживающие.
Сиптоматический эффект описан у 60% больных после применения дексаметазона, а у 61% из них снизился уровень PSA. По данным Nishimura K, et al (2000) оральное применение низких доз Дексаметазона (0,5 – 2 мг/день) оказалось эффективным в лечение больных ГР-РПЖ: у 62% больных данной патологией отмечалось снижение уровня сывороточного PSA >= 50% (снижение уровеня PSA дополнительно подтверждено через 4 недели). В 61% случаев уменьшился болевой синдром, в 10% случаев отмечено повышение уровня гемоглобина крови минимум на 2 г/л.
Химиотерапия
РПЖ-опухоль малочувствительная к химиотерапии. Эффективность химиотерапии в лечении ГР-РПЖ долгое время оставалась низкой. Yagoda and Petrylak (1993) сообщают лишь о 8.7% случаев ответа на химиотерапию. В течение последних нескольких лет были разработаны современные лекарственные препараты. Новыми терапевтическими мишенями стали Bcl-2, EGF, p53, топоизомеразы (таблица 1).
Таблица 1. Терапевтические мишени современных химиопрепаратов для лечения ГР-РПЖ
|
Терапевтическая мишень
|
Группа
|
Препарат
|
|
Bcl-2
|
Таксаны
|
Доцетаксел
|
|
Ядерный матрикс,
Р-гликопротеин
|
Эстрамустины
|
Эстрамустин
|
|
Топоизомераза
|
Митоксантроны
|
Митоксантрон
|
|
Цитоплазматические микротрубочки митотического веретена
|
Алкалоиды Vinca
|
Винбластин, Винкристин
|
Митоксантрон, ингибитор топоизомеразы II, используется для лечения ГР-РПЖ в сочетании с преднизолоном . Kantoff et al., (1999) сообщают о более высокой эффективности применения схемы митоксантрон 14 мг/м2 + гидрокортизон 40 мг по сравнению с монотерапией гидрокортизоном 40 мг.
В.А.Бирюков и О.Б. Карякин (2003) сообщают об эффективности лечения ГР-РПЖ митоксантроном в сочетании с преднизолоном. Так, снижение уровня ПСА более чем на 50% отмечено у 23,8% пациентов, у 9% больных ПСА снизился в пределах от 25 до 50%. Со стороны пораженных лимфатических узлов ответ на лечение составил 33%.Комбинация эстрамустина с винбластином (VP-16) хорошо зарекомендовала себя при лечении больных ГР-РПЖ (Pienta KJ, 1994). Данная схема лечения обеспечивает снижение уровня ПСА>= 50% у 45-52% больных, а клинический ответ у 26-33% больных .
Монотерапия таксанами (доцетаксел, паклитаксел) или их сочетание с эстрамустинами эффективно используется в лечении больных ГР-РПЖ. Доклинические испытания продемонстрировали, что, несмотря на единую природу, доцетаксел и паклитаксел влияют на разные митотические структуры, тормозят клетки на разных фазах митоза. Основным механизмом противоопухолевой активности таксанов до недавнего времени считался процесс деполимеризации цитоплазматических микротрубочек митотического веретена, однако современные исследования доказали эффективность доцетаксела, паклитаксела в ингибировании анти-апоптозного протоонкогена Bcl-2. Причем эффективность фосфорилирования Bcl-2 в 100 раз выше у доцетаксела, нежели у паклитаксела. Рекомендованный режим дозирования паклитаксела – 75 мг/м2, доцетаксела – 40-80 мг/м2 каждые 3 недели. В этом случае выявлен эффект снижения ПСА?50% у 62% больных и частичный ответ (уменьшение мягкотканных очагов) у 25% больных (Schultz M et al, 1999). При комбинировании таксанов с эстрамустином отмечается значительный положительный эффект.В.А.Бирюков и О.Б. Карякин (2003) сообщают об эффективности лечения ГР-РПЖ доцетакселом в комбинации с преднизолоном. Так, снижение уровня ПСА отмечено у 38% пациентов, из них у 30,7% уровень ПСА снизился более чем на 50% от исходного, до начала лечения. Положительная динамика со стороны пораженных лимфоузлов отмечалась у 70% пациентов, причем полная регрессия зарегистрирована у 14%, частичная регрессия у 14% и стабилизация процесса у 42% больных.На базе РОНЦ РАМН проводится исследование различных схем химиотерапии, применяемых для лечения ГР-РПЖ. В исследование включены 69 больных, страдающих гормонорезистентной формой рака предстательной железы, которые получали лечение в РОНЦ РАМН в период с 1999 по 2003 гг. Были исследованы эффективность и токсичность 5-ти различных схем химиотерапии.
Химиотерапия по схеме: навельбин 25 мг/м2 внутривенно – 1-й и 5-й дни; циклоплатам (100 мг/м2 внутривенно – 2-й, 3-й и 4-й дни) проводилась 23 пациентам в возрасте от 51 года до 74 лет (средний возраст – 65 лет). Хирургическая кастрация в анамнезе проводилась 13 пациентам, медикаментозная кастрация была у 10 пациентов. Среднее время до развития гормональной резистентности составило 25 месяцев (6 – 72). Средний уровень сывороточного ПСА на момент начала химиотерапии составлял 337,4 нг/мл (от 4,3 нг/мл до 4141,8 нг/мл). Общее состояние больных, оцененное по шкале ВОЗ, составило: 0 – 3 (13%), 1 – 8 (34,8%), 2 – 10 (43,5%), 3 – 2 (8,7%). При ежемесячном анализе ПСА на фоне химиотерапии было установлено, что рост ПСА через 4 недели после окончания 1-ого курса химиотерапии наблюдался у 12 пациентов (52,2%). Ремиссия течение 1 месяца отмечена у 8 пациентов (34,8%), ремиссия в течение 2 месяцев - у 1 (4,3%). Более 4 месяцев длительность снижения ПСА наблюдалось 2 пациентов (8,7%). Снижение ПСА более чем на 50% зафиксировано у 4 пациентов (17,4%).Химиотерапия по схеме: доцетаксел (таксотер) 75 мг/м2; эстрамустина фосфат (эстрацит) 300 мг/м2 ежедневно длительно, преднизолон по 10 мг ежедневно длительно проводилась 8 пациентам. По предварительным данным прогрессирование отмечено у 2 пациентов (25%); стабилизация – у 3 пациентов (37,5%); частичная регрессия – у 3 пациентов (37,5%). Регрессия ПСА отмечена у 4 пациентов (50%). Снижение ПСА более чем на 50% зафиксировано у 3 пациентов (37,5%).Химиотерапия по схеме: новантрон (митоксантрон) 12 мг/м2 внутривенно; преднизолон по 10 мг в день длительно проводилась 22 пациентам. По предварительным данным прогрессирование отмечено у 16 пациентов (72,7%); стабилизация – у 4 пациентов (18,2%); частичная регрессия – у 2 пациентов (9,1%).Химиотерапия по схеме: новантрон (митоксантрон) 12 мг/м2 внутривенно; цисплатин 60 мг/м2 внутривенно; преднизолон по 10 мг в день длительно проводилась 7 пациентам. По предварительным данным прогрессирование отмечено у 4 пациентов (57,1%); частичная регрессия – у 3 пациентов (42,9%). Снижение ПСА более чем на 50% зафиксировано у 3 пациентов (42,9%).Химиотерапия по схеме: Доксорубицин (адриабластин) 20 мг/м2 в 1-й день 1, 3, 5 недели; кетоконазол (низорал) 1200 мг в день 1-7 дни 1, 3, 5 недели; доцетаксел (таксотер) 20 мг/м2 в 1-й день 2, 4, 6 недели; эстрамустина фосфат (эстрацит) 420 мг в сутки 1-7 дни 2, 4, 6 недели, преднизолон по 10 мг в день длительно проведена 5 пациентам. По предварительным данным прогрессирование отмечено у 2 пациентов (40%); стабилизация – у 2 пациентов (40%); частичная регрессия – у 1 пациента (20%). Регрессия ПСА отмечена у 4 пациентов (80%). Снижение ПСА более чем на 50% зафиксировано у 3 пациентов (60%).
Таким образом, на основании проведенных исследований можно предположить, что использование Касодекса 150 мг у тяжелейшего контингента больных ГР-РПЖ позволяет достичь медианы выживаемости в 11 месяцев, что является определенным успехом.
Использование полихимиотерапии с включением таксанов позволяет улучшить результаты лечения по сравнению с другими видами лекарственной терапии. Данные схемы наименее токсичны и перспективны для дальнейшего изучения.
Авторы: Б.П.Матвеев, Б.В.Бухаркин
отделение урологии ГУ Российского научного центра им.Н.Н.Блохина РАМН



