В России традиционно лучевая терапия при распространенном раке яичников применяется как дополнительный метод лечения пациенток с опухолями, не ответившими на химиотерапию. У больных с частичным эффектом от химиотерапии лучевая терапия также дает возможность улучшить результаты лечения. Данный метод может быть полезен и для паллиативного лечения инкурабельных больных с большими тазовыми опухолями или отдаленными метастазами.
Сегодня схема лечения РЯ подбирается индивидуально с учетом основных прогностических факторов. Наиболее важны три независимых показателя. На их основе предлагается распределять больных в группы риска:
- стадия заболевания
- степень дифференцировки опухоли
- объем остаточной опухоли
Основываясь на этих независимых факторах можно выделить 3 прогностические группы:
|
с низким риском (Low Risk) |
I стадия и высокодифференцированная опухоль |
|
промежуточным (Intermediate Risk) |
I и II стадии, дифференцировка опухоли G2 и G3; IIIа стадия и высокодифференцированная опухоль |
|
высоким риском (High Risk) |
II стадия с низкодифференцированной опухолью и III, IV стадии |
После циторедуктивных операций у больных, входящих в группу высокого риска, проводят 6-8 курсов полихимиотерапии. В группах промежуточного и высокого риска нередко применяется мультимодальная тактика лечения. После стандартного числа курсов химиотерапии эффект оценивается повторно, и определяются группы больных для возможного облучения области таза или всей брюшной полости. Кроме того, рассматривается вопрос об интраперитонеальном введении радиоактивных препаратов (золота или фосфора).
В некоторых зарубежных клиниках внутрибрюшное введение радиоактивных изотопов преимущественно применяется после радикальных операций у больных раком яичников I-III стадий, при размерах остаточной опухоли до 2 см. Этот метод позволяет добиться равномерного облучения брюшной полости с хорошими результатами, но действие препарата ограничивается глубиной воздействия на опухоль от 1,5 до 3 мм. Этот метод не пригоден при метастазах в лимфатических узлах. Кроме того, больший процент осложнений (спаечная болезнь, кишечная непроходимость и некрозы стенки кишки) не позволяет применять его широко.
Показания:
- локальная остаточная опухоль или метастатически измененные лимфатические узлы у больных РЯ II – IV стадий, дифференцировка опухоли G2- G3 после стандартного комбинированного лечения (операция + 6 и более курсов химиотерапии);
- рецидивы РЯ после повторных циторедуктивных операций или химиотерапии.
Противопоказания: тяжелое соматическое состояние больной, связанное с сопутствующими заболеваниями или генерализацией основного заболевания.
Эффективность лучевой терапии при лечении рецидивов РЯ такая же, как при лечении первичной опухоли, и зависит от размеров опухоли и толерантности окружающих тканей. При лучевой терапии первичных и рецидивных образований возможно применять как методики облучения всего живота, так и отдельных областей.
Способы подведения доз при наружном облучении всей брюшной полости
Хорошо исследованы 2 способа:
- Техника движущихся полос (Moving Strip Technique). Имеет ряд недостатков:
- возможен перенос опухолевых клеток из необлученной области в область, получившую предварительное лечение, т.к. часть объема какое-то время не облучается
- возможно суммирование доз в области подвижных органов (тонкий и толстый кишечник), что может увеличить процент поздних осложнений этих органов
- Техника открытых полей. Наиболее популярна сегодня, т.к. позволяет лечить весь объем ежедневно, включая всю брюшину, парааортальные лимфатические узлы, мезентериальные, поддиафрагмальную область и таз
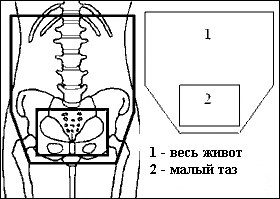
Рисунок 1. Схема последовательного облучения брюшной полости и таза с уменьшением полей в процессе курса
Предлагается определять верхнюю границу поля для лучевой терапии на 1-2 см выше купола диафрагмы, нижнюю – основанием запирательных отверстий, латеральные – на 1-2 см cнаружи от боковых границ живота. При дополнительном облучении таза (тазовый буст) используют 4-х польную методику, технику переднезадних полей или ротационные методы.
При планировании облучения всего живота должны соблюдаться общие принципы:
- использовать открытые поля, позволяющие адекватно охватывать всю брюшную полость
- использовать параллельные встречные поля, позволяющие уменьшать дозу с помощью блоков на области с высоким риском тяжелых осложнений
- применять высоко энергетическое фотонное излучение с вариацией доз в объеме не более 5%
- суммарная доза на живот должна составлять 22,5-30Гр, разовая 1-1,5Гр. Тазовые поля следует уменьшать, дополнительно подводя на таз дозы до 45-50Гр при 1,8-2Гр за фракцию
- рутинное использование парааортального буста не рекомендуется, т.к. процент осложнений увеличивается
- блок на печень нужно ставить так, чтобы правая часть диафрагмы получала полную дозу 30Гр
- с помощью блоков и экранов ограничивать дозу на почки до 18-20Гр
Есть мнение, что при осуществлении основных методик облучения (открытые поля и методика движущихся полос), при процедуре экранирования почек и печени, используемой во многих центрах, создается неравномерное распределение дозы облучения по брюшной полости.
Для равномерного распределения дозы в объеме живота, предложена техника шестипольного облучения (представлена Эйнхорном и соавторами в 1986 году).
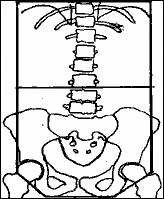
Рисунок 2. Общая схема лечения по Einhorn. Границы полей облучения по шестипольной методике (прямая проекция)
Лечение осуществляется в 3 этапа:
- облучение всей брюшной полости проводится с двух противолежащих полей, с ежедневной дозой 1,2 Гр, суммарной – 20Гр (16 фракций)
- размеры полей уменьшают: верхняя граница поля – диск L3– L4, нижняя остается на уровне запирательных отверстий. Разовая доза – 1,6Гр, суммарная – 20Гр (12 фракций) подводится с двух встречных переднезадних полей.
- применяют то же фракционирование (1,6Гр/20Гр за 12 фракций), но дозу подводят с двух боковых полей на область от верхней границы брюшины до середины L3, соблюдая расстояние приблизительно 1 см от предыдущего нижнего поля. Это расстояние признано адекватным с учетом расхождения пучков. Задняя граница облучаемого объема проходит по телам позвонков, передняя – по передней поверхности живота.
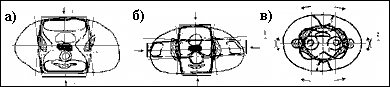
Рисунок 3.
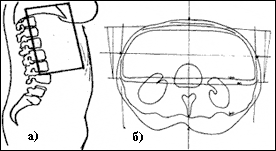
Рисунок 4. Третья фаза лечения а) границы поля облучения верхней части живота [боковая проекция], б) распределение поглощенной дозы в верхней части живота [поперечный срез])
Общее время лечения - 8 недель, 80% верхней части живота и таз облучали СОД 40Гр, а 20% верхней части живота (задние отделы брюшной полости, 2/3 почек, 1/2 печени) – 20Гр.
Возможные осложнения лучевой терапии
- повышение температуры
- потеря веса
- тошнота, рвота
- диарея
- общая слабость, анемия
- лейкопения
- тромбоцитопения
- базальные пневмониты
Радиоиндуцированный нефрит – известное осложнение при дозах облучения, превышающих 23 Гр на область почек. Биохимические доказательства дисфункции печени – повышение щелочной фосфатазы, сывороточных трансаминаз и лактатдегидрогеназы, наблюдается у 25-50% пациенток, однако клиническое развитие гепатита, как и нефрита, встречается достаточно редко (менее 1%) при соответствующей защите печени и почек. В целом, токсичность брюшно-тазового облучения более тяжелая после химиотерапии, чем при самостоятельном применении метода.
Эффект после ЛТ должен быть оценен через месяц, во время лечения часто повышается уровень СА-125, который снижается только через 2-3 месяца после окончания лечения.



